 뉴스센터
뉴스센터
![[코로나19 과학 리포트 2]_Vol.9 자연에서 발견한 코로나19 치료 후보물질](https://www.ibs.re.kr:443/dext5data/2021/03/20210308_133942170_18578.jpg)
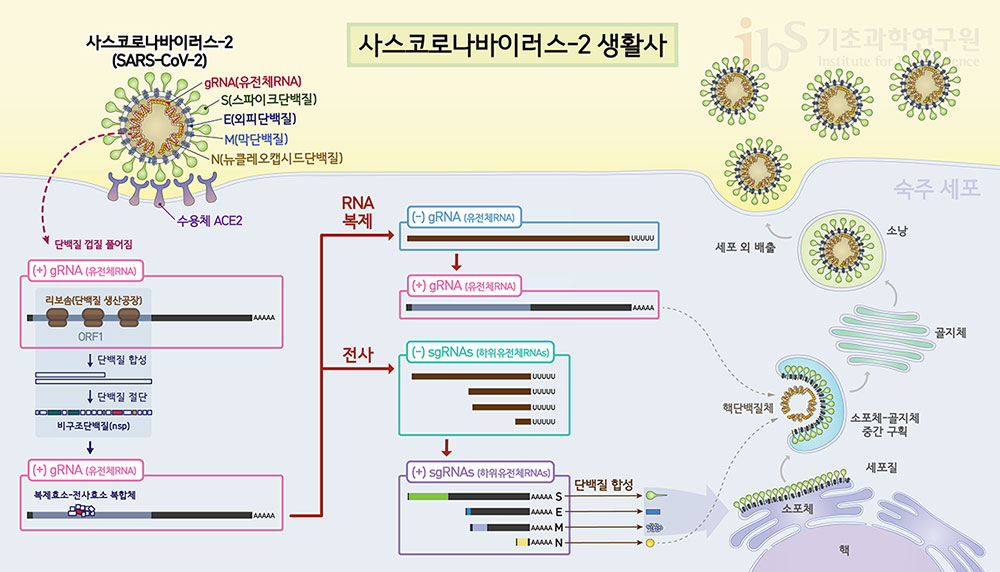
코로나19 치료제는 감염된 세포가 바이러스에 대항할 도구를 사후적으로 우리 몸에 공급한다. 따라서 바이러스에 대한 방어 체계를 사전 구축하는 백신과는 상호보완적이라 할 수 있다. 체내의 세균을 표적으로 삼는 항생제와 달리, 바이러스 치료제는 바이러스 입자 자체를 파괴하도록 설계되진 않는다. 바이러스의 외피는 숙주세포의 세포막과 구성이 거의 동일해서, 바이러스를 파괴하려다 숙주세포에도 손상을 입힐 수 있다. 즉, ‘빈대 잡으려다 초가삼간 다 태우는’ 상황을 막기 위함이다. 대신, 바이러스 질환 치료제 개발은 바이러스 생활사 중 하나 이상의 단계를 공략하는 전략을 취한다. 코로나19 치료제의 작용원리를 이해하기 위해서는 사스코로나바이러스-2가 숙주 내에서 활동하는 생활사를 먼저 들여다 볼 필요가 있다. 사스코로나바이러스-2가 우리 몸에 들어와 증식하는 과정
사스코로나바이러스-2는 표면의 돌기(스파이크단백질)를 이용하여 인체 세포의 ACE2 수용체와 결합하여 세포 내로 침투한다. 이후 바이러스의 외포와 숙주세포 세포막 사이 막 융합이 일어나며 유전물질인 게놈RNA(gRNA)가 인체세포의 세포질로 들어오게 된다. 초기에는 인체세포의 효소를 이용하여 필요한 단백질을 만든다. 이때 만들어진 단백질 중 하나인 RNA중합효소(RdRp)는 바이러스 증식에 핵심적인 역할을 한다. 바이러스 RNA를 대량으로 복제하는 한편 바이러스 구조물을 만든다. 최종적으로 이들은 인체세포 안에서 코로나바이러스 완전체로 다시 조합되어 세포 밖으로 빠져나간다. 이러한 사스코로나바이러스-2 생활사의 어떤 단계라도 저해하는 물질은 체내 바이러스 증식을 억제하는 효과를 낸다. 즉, 사스코로나바이러스-2에 대한 치료효과를 기대할 수 있다는 뜻이다. 가령, 항체치료제는 스파이크단백질에 달라붙어 생활사의 첫 단계인 ACE2와 스파이크단백질의 결합을 막는다. 코로나19 치료제로 최초 승인된 ‘렘데시비르’는 RNA중합효소에 결합하여 복제를 저해하고, 팬데믹 초반에 각광받은 ‘클로로퀸’과 ‘하이드록시클로로퀸’은 사스코로나바이러스-2 gRNA의 방출을 막아주는 역할을 한다(코로나19 과학 리포트 2 Vol.8 참고). 사스코로나바이러스-2가 ACE2에 결합한 후 세포 내로 들어오는 과정을 조금 더 자세히 살펴보자. ACE2에 결합한 스파이크단백질은 세포의 단백질 분해효소에 의해 절단되고, 스파이크단백질의 S2 부위가 밖으로 노출된다. 이 부위가 사스코로나바이스-2 외피와 세포막 간 막 융합을 매개하는 역할을 한다. 스파이크단백질은 세포 내 엔도좀이나 라이소솜에 존재하는 카텝신(cathepsin) 혹은 세포막에 위치한 TMPRSS2라는 단백질 분해효소에 의해 절단된다. 이들 단백질 분해효소의 활성을 억제한다면, 막 융합 단계를 저해하여 바이러스의 세포 침투를 차단할 수 있다. 위에서 언급한 클로로퀸과 하이드록시클로로퀸은 엔도좀의 산성을 높여 카텝신의 활성을 저해하며, ‘카모스타트(camostat)’와 ‘나파모스타트(nafamostat)’ 등 약물들은 대표적인 TMPRSS2 저해제다. 참고로 클로로퀸계열의 약물은 코로나19에 치료 효과가 뚜렷하지 않아 WHO에서 사용중지 공고를 내렸고 현재는 TMPRSS2 저해제를 이용한 코로나19 임상시험이 활발히 진행되고 있다. 이는 우리나라도 마찬가지다. 종근당은 ‘나파벨탄’, SK케미칼의 ‘후탄’, 대웅제약의 ‘호이스타정’, 크리스탈지노믹스의 ‘CG-CAM20’ 등이 TMPRSS2의 저해제들이다. 천연물에서 얻은 바이러스 치료제
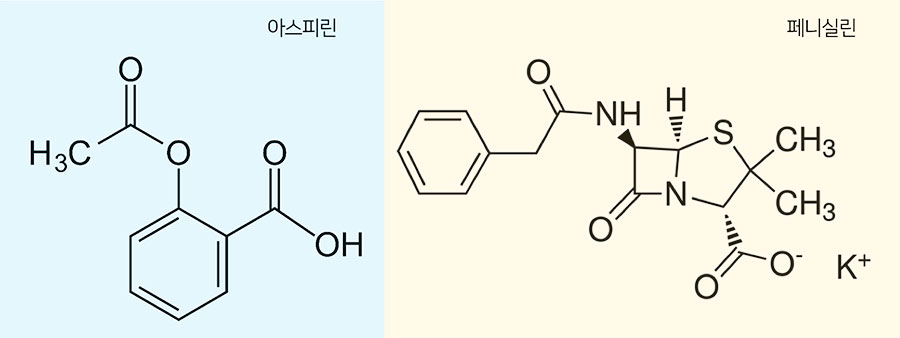
인류는 역사적으로 자연으로부터 약물을 찾고, 약제를 개발하여 수많은 질병을 극복해왔다. 아스피린과 페니실린이 대표적이다. 아스피린은 버드나무 껍질에서 추출한 살리실산(salicylic acid)에서, 페니실린은 푸른곰팡이에서 탄생했다. 비교적 최근에는 중국의 투 유유 교수가 전통약재인 개똥숙에서 말라리아 치료제 ‘아르테미시닌’을 찾아낸 사례가 있다. 투 유유 교수는 말라리아 퇴치에 크게 기여한 공로로 2015년 노벨생리의학상을 수상했다. 천연물 유래 치료제는 우리 주위에서 쉽게 접할 수 있고, 수백~수천 년 동안 사용되어 안정성이 입증됐다는 장점이 있다. 그중에서도 항바이러스 효과를 갖는 천연물을 찾는 노력은 오래도록 계속돼 왔다. 하지만 아직 천연물 바이러스 치료제라고 떳떳하게 내 놓을 수 있는 물질을 찾기 어려운 것도 현실이다. 1996년 미국의 길리어드사이언스가 개발한 인플루엔자 치료제 ‘타미플루’의 사례를 보자. 신종플루 치료제로도 유명한 타미플루는 중국 토착식물인 팔각회향에 함유된 시킴산(shikimic acid)으로부터 유래됐다. 하지만 엄밀히 말해서 타미플루를 천연물 항바이러스제라고 하기는 어렵다. 타미플루는 시킴산을 원료로 다단계 화학 합성을 통해 만들어진다. 다만 시킴산을 합성 출발물질로 이용했을 뿐, 시킴산 자체에는 항바이러스 활성이 전혀 없다. 팔각회향을 달여 먹는다고 해도 독감에 대한 치료 및 예방효과를 기대할 수 없다는 의미다. 한편, 2003년 사스(SARS‧중동급성호흡기증후군) 유행 당시 독일 프랑크푸르트대 의대 연구진은 감초의 성분인 ‘글라이시리진(glycyrrhizin)’이 사스코로나바이러스의 복제를 억제한다는 연구결과를 의학전문지인 ‘란셋(Lancet)’에 보고한 바 있다(Cinatl et al., 2003). 그러나 논문에 대한 큰 반향과 달리, 실제 치료제 개발로 이어지지는 않았다. 코로나19 발생 이후 전 세계 많은 학자들이 항-사스코로나바이러스-2 활성을 갖는 천연물을 찾기 위해 고군분투하고 있다. 초기연구는 가능성 제시에 그쳤으나, 최근 의미 있는 연구들이 속속 보고되고 있다. 그중 눈에 띄는 것은 스페인 제약회사인 파마마(PharmaMar, S.A.)가 개발한 ‘플리티뎁신(Plitidepsin)’이다. 플리티뎁신은 만두멍게속(Aplidium)에 속하는 해양생물(Aplidium albicans)에서 분리한 물질이다. 본래 다발성 골수종(multiple myeloma) 치료제로 사용됐던 항암제였으나 약물재창출 차원에서 시험해본 결과 코로나19 치료 가능성이 확인됐다. 원숭이 신장세포(VERO)에 대한 IC50(코로나바이러스 활성도를 50% 저해하는 약물농도)가 1 nM 이하로 나왔다. 사람 ACE2 수용체를 발현한 쥐 실험에서도 사스코로나바이러스-2 감염을 현저히 감소시키는 것으로 나타났다(White et al., 2021). 도라지의 플라티코딘 D, 바이러스의 모든 침입 경로 차단도라지(길경, Platycodon grandiflorus)는 한국을 포함한 동아시아 지역에서 전통적으로 사용돼온 천연물 약재다. 도라지 정과나 구이처럼 우리나라에서는 식용으로도 많이 쓰인다. 인후통, 감기로 인한 기침, 가래, 기관지염 등에 효과가 있는 것으로 널리 알려져 있는데, 이는 도라지 속 플라티코딘 D(playcodin D)라는 성분 덕분이다. 플라티코딘 D는 도라지에 풍부한 트리테르페노이드 사포닌(triterpenoid saponins)의 일종이다.
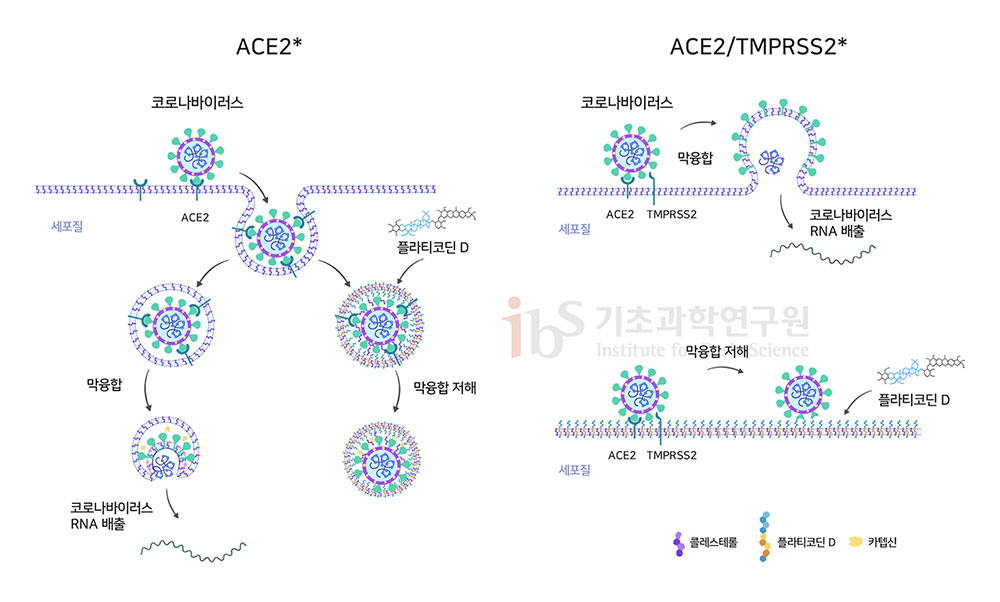
필자가 이끄는 IBS 인지 및 사회성 연구단은 호흡기 질환 치료효과가 있는 플라티코딘 D의 코로나19 치료 효능에 대한 연구를 시작했다. 코로나19 역시 급성 호흡기 질환이기 때문이다. 우선 우리 연구진은 사스코로나바이러스-2와 꼭 닮은 ‘가짜 바이러스’를 만들었다. 슈도바이러스라고 불리는 이 유사 바이러스는 사스코로나바이러스-2처럼 스파이크단백질을 발현한다. 살아있는 바이러스를 연구하려면 생물안전 3등급 연구시설이 필요하지만, 슈도바이러스는 생물안전 2등급 시설에서도 실험이 가능하다. 또한, 슈도바이러스는 사스코로나바이러스-2의 여러 구성 물질 중 세포 내 진입에 관여하는 스파이크단백질만을 가지고 있다. 따라서 바이러스의 진입, 즉 감염 능력만을 선택적으로 측정하기 유리하다. 앞서 생활사를 통해 설명했듯, 사스코로나바이러스-2가 세포 내로 진입하려면 카텝신 혹은 TMPRSS2에 의한 스파이크단백질의 절단과 바이러스-세포 간 막 융합이 필요하다. 클로로퀸과 하이드록시클로로퀸이 수많은 임상시험에서 실패한 이유는 카텝신 활성 저하에는 성공했지만, TMPRSS2에 의한 진입을 막지 못해서였다(Hoffman et al., 2020). 마찬가지로 TMPRSS2를 타깃한 다른 저해제들 역시 엔도좀을 통해 들어오는 바이러스 감염을 막지 못한다는 태생적 한계가 있다. 우리 연구단은 카텝신과 TMPRSS2에 의한 사스코로나바이러스-2 진입 경로를 세포에서 재현하고자 했다. 이에 사람 폐 세포주(H1299)에 ACE2 혹은 ACE2+TMPRSS2를 발현시키고, 플라티코딘 D의 감염억제 효과를 분석했다. 그 결과 플라티코딘 D는 두 개의 상이한 진입 경로를 모두 효과적으로 억제한다는 사실을 발견했다. 사스코로나바이러스-2가 세포 침투를 위해 어떤 경로를 사용하든 차단해 낼 수 있다는 의미다. 이어 도라지를 주요 성분으로 하는 천연물 의약품과 식품 중에 ‘용각산’과 ‘도라지 청’을 선택하여 코로나19 치료 효과도 측정했다. 그 결과, 매우 낮은 농도에서도 사스코로나바이러스-2 감염 억제 효과를 관찰했다. 한편, 인삼의 사포닌인 ‘진세노사이드’와 효능을 비교한 실험에서는 플라티코딘 D만 효과를 보였다. 항 사스코로나바이러스-2 효과는 도라지에만 존재하는 사포닌인 플라티코딘 D의 특성이라는 의미다. 슈도바이러스 뿐만 아니라 살아있는 감염성 사스코로나바이러스-2를 사용한 실험에서도 동일한 결과를 얻었다. 기존 개발 중인 진입억제제(클로로퀸, 카모스타트, 나파모스타트 등)와 비교했을 때 플라티코딘 D만 유일하게 두 개의 사스코로나바이러스-2 세포 감염경로를 모두 효과적으로 저해한다는 사실을 재차 확인했다.
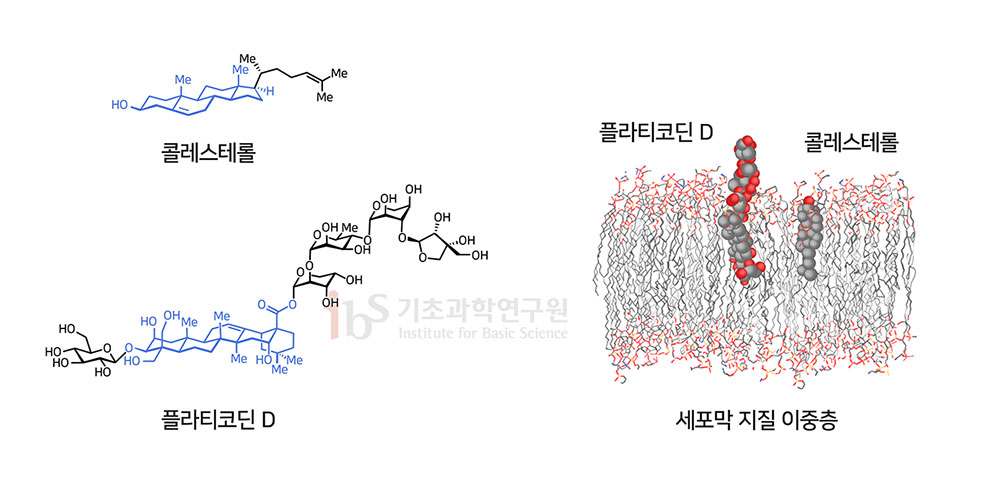
그렇다면 왜 플라티코딘 D만 이런 활성을 보이는 걸까. 분석 결과 플라티코딘 D의 중심 구조가 세포막의 주요 구성물질인 콜레스테롤과 매우 유사하기 때문인 것으로 확인됐다. 즉 콜레스테롤과 똑 닮은 부위에 양쪽으로 길게 당이 붙어있는 구조라고 생각하면 된다. 세포가 콜로스테롤과 같이 플라티코딘 D을 세포막안으로 받아들이고 플라티코딘의 긴 당 부위가 세포막 밖으로 돌출되면 이부분이 바이러스러스 감염의 필수과정인 막융합을 저해하는 것이다. 요컨대 우리 연구진은 플라티코딘 D가 두 개의 바이러스 침입 과정을 모두 막는 새로운 코로나19 치료 후보약물이 될 수 있다는 가능성을 제시했다. 이는 기존 개발 중인 진입억제 후보약물들의 한계점을 극복한 것이다. 해당 연구결과는 현재 바이오아카이브에 올라와 있다(Kim et al., 2020). 최근 사스코로나바이러스-2 체내 수용체인 ACE2와 TMPRSS2가 폐보다 코를 포함하는 상기도 상피세포에 많이 존재한다는 연구결과들이 발표됐다(Sungnak et al., 2020; Hou et al., 2020). 이들 연구결과는 코로나19 감염 초기 상기도에서 사스코로나바이러스-2의 양(viral load)이 급속도로 증가하여 후각상실과 무증상 감염을 야기하며, 이후 하기도로 내려가 폐를 감염시킨다는 것을 의미한다. 그렇다면 상기도에서 사스코로나바이러스-2 체내 감염을 저지하면 중증으로 진행 없이 초기에 코로나19를 치료할 수 있다는 의미가 된다.
플라티코딘 D는 일상생활에서 접할 수 있는 식품 및 생약의 주요성분으로 쉽게 섭취가 가능하다. 아직 세포실험 단계이기에 속단하기는 이르지만, 상기도의 상피세포에 고농도로 투약할 수도 있어 약물로 개발됐을 때 무증상환자나 초기 환자에게 치료 효과를 기대할 수 있을 것이다. 우리 연구진은 현재 동물실험을 준비하고 있다. 동물실험에서도 좋은 결과가 나온다면 우리가 오랫동안 섭취해 온 식품 및 생약 성분이기 때문에 임상 시험은 무리 없이 진행될 수 있을 것이다. 그간 선진국의 연구자들을 중심으로 코로나19 백신과 치료제 개발 성과들이 앞 다투어 발표됐다. 이는 선진국에 그만큼의 기초연구 성과가 축적되었기에 가능했던 일이다. 그러나 우리나라는 방역에 있어서는 세계적 주목을 받았지만, 이렇다 할 개발 성과를 내지는 못했다. 이번 연구를 계기로 천연물 유래 코로나19 치료제가 우리나라에서 최초로 개발되기를 기대해본다. ▣ 참고문헌Cinatl et al. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus Lancet. 2003 Jun 14;361(9374):2045-6 White et al. Plitidepsin has potent preclinical efficacy against SARS-CoV-2 by targeting the host protein eEF1A. Science. 2021 Jan 25 Hoffmann et al. Chloroquine does not inhibit infection of human lung cells with SARS-CoV-2. Nature. 2020 Sep;585(7826):588-590 Kim et al. Platycodin D prevents both lysosome- and TMPRSS2-driven SARS-CoV-2 infection in vitro by hindering membrane fusion. Biorxiv (2020.12.22.423909v1) Sungnak W et al. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med. 2020 May;26(5):681-687. Hou et al., SARS-CoV-2 Reverse Genetics Reveals a Variable Infection Gradient in the Respiratory Tract. Cell. 2020 Jul 23;182(2):429-446. 글 | 이창준 기초과학연구원(IBS) 인지 및 사회성 연구단 단장 편집 | IBS 커뮤니케이션팀 발행일 | 2021년 3월 8일 본 글의 저작권은 기초과학연구원에 있습니다. 무단 전재를 금지하며 공유‧인용 및 재사용 시에는 출처를 명시해주시기 바랍니다. |
| 다음 | |
|---|---|
| 이전 |
- 콘텐츠담당자
- :
- 최종수정일 2023-11-28 14:20