
 뉴스센터
뉴스센터
![[코로나19 과학 리포트 2]_Vol.1 코로나19 바이러스 변이체 위협적인가?](https://www.ibs.re.kr:443/dext5data/2021/01/20210125_110514263_74672.jpg)
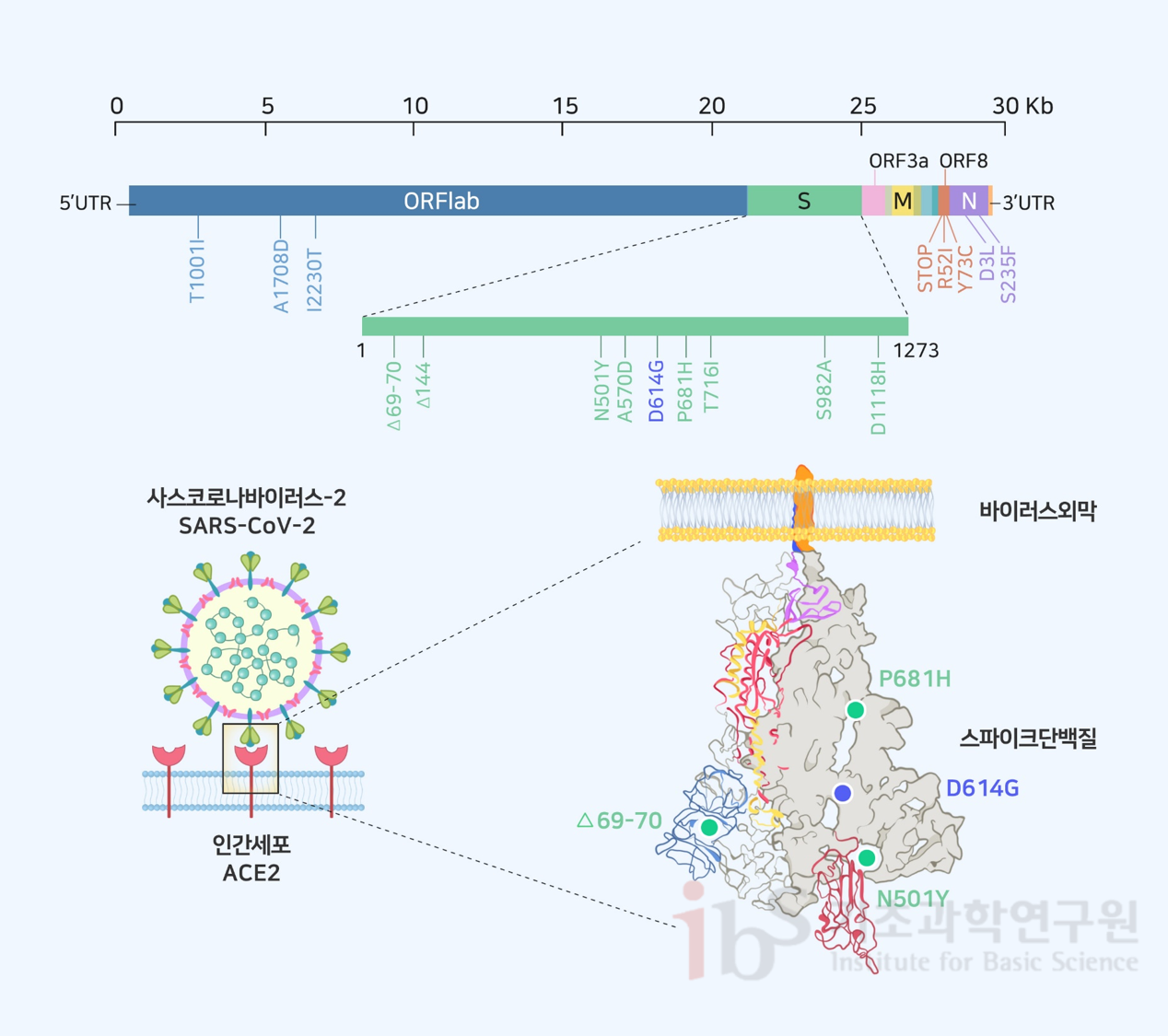
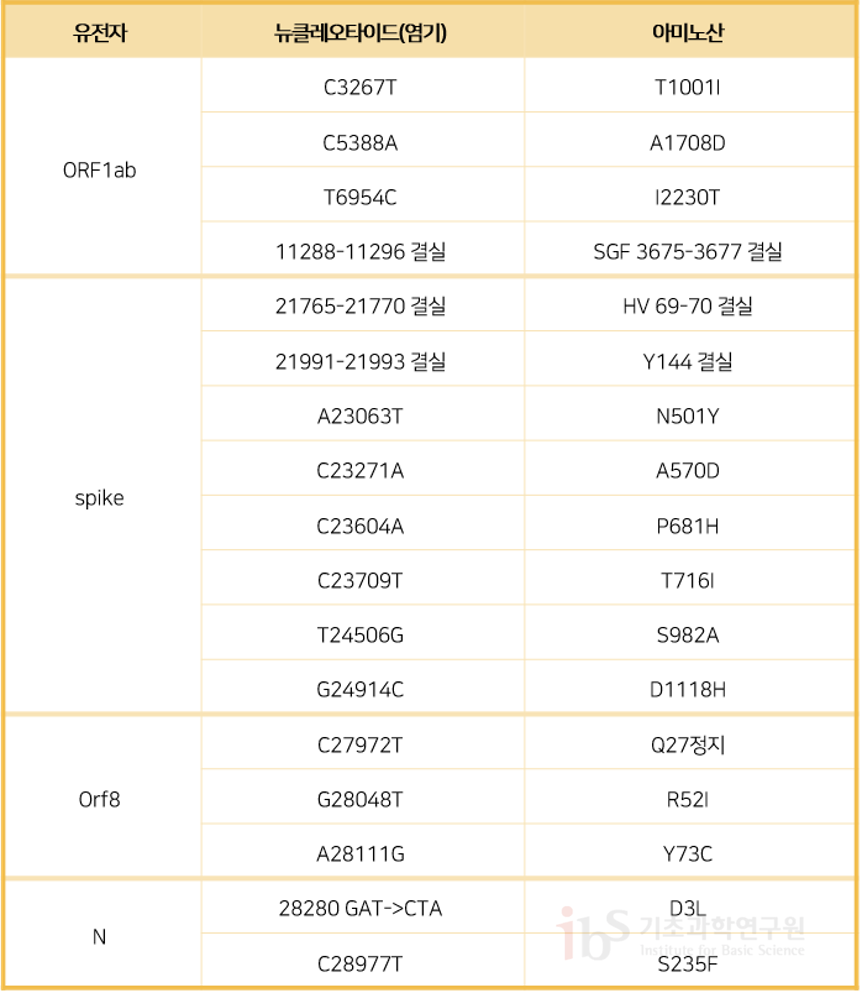
바이러스 변이체, 독성은 오히려 약화될 수도 있다백신 개발 이후 사스코로나바이러스-2(SARS-CoV-2)와 벌인 긴 싸움의 끝이 보이기 시작했다. 하지만 바이러스 변이체(돌연변이)가 영국, 남아프리카공화국, 일본 등에서 확산되고 있다는 소식이 들려왔다. 이는 또 다른 위기의 전조인가? 바이러스 전파력과 독성은 차이가 있는가? 백신으로 막을 수 있는가? 관련된 질문과 논란이 꼬리를 물며 이어진다. 사스코로나바이러스-2의 스파이크 단백질 변이로 전파능력이 높아졌다는 발표가 있었지만, 과학자들은 더 면밀한 검증이 필요하다고 지적한다. 또 바이러스 전문가들은 외피 단백질 변이가 독성을 약화시킨다는 분석을 내놓고 있다. 역사적으로 인류를 괴롭힌 바이러스들도 출몰 이후 시간이 갈수록 전파력은 높아지고 독성은 떨어지는 진화의 추세를 보였다. 다행히 최근 미국 화이자와 독일 바이오엔테크는 자사의 백신이 영국과 남아프리카공화국의 돌연변이에 효과가 있음을 입증했다고 밝혔다. 다만 연구 결과는 전문가 동료들의 평가를 거친 정식 논문이 아니라 논문 사전 공개 사이트인 바이오아카이브에 공개됐다. 영국에서 발생한 사스코로바이러스-2 변이체최근 세계는 영국 남동부 지역에서 발견된 새로운 사스코로나바이러스-2 돌연변이체의 출현을 예의주시하고 있다. 이 변이체는 사스코로나바이러스-2 VUI 202012/01 혹은 B117 계열이라고 명명되었다. 영국 정부와 연구진의 발표에 의하면 B117은 이전의 다른 버전들보다 전염성이 더 강하고 유전적으로도 특이하다. 그러나 B117이 변종 슈퍼바이러스는 아니다. 기존 사스코로나바이러스-2 변이체의 일종이다. 변이체 유행에 대한 막연한 두려움을 피하려면 우선 돌연변이에 대한 이해가 필요하다. 유전자를 이루는 염기서열의 변화로 유전정보가 변하면서 유전형질이 달라지는 변이현상을 돌연변이라 한다. 염기는 모두 4가지인데. 아데닌(A)과 티민(T) (DNA 염기 T는 RNA에서 유리딘(U)으로 바뀐다), 시토신(C)과 구아닌(G)이 서로 선택적으로만 반응한다. 즉 원판인 DNA의 염기서열이 정해지면, 복사본 DNA의 염기서열도 결정됨을 뜻한다. 이런 방식으로 원판 DNA의 염기 배열은 복사본 DNA를 만들거나, 또는 RNA로 전사·번역되어 단백질의 구성 요소인 아미노산을 생산한다. 만약 DNA 염기 배열이 흐트러지거나, 염기 중 일부가 바뀌면 유전정보에 오류가 발생하여 아미노산 조합의 최종산물인 단백질에도 변화가 불가피하다. 이는 곧 새로운 변이의 출현을 의미한다. 바이러스는 종에 따라 유전체가 RNA일 수도 있고 DNA일 수도 있다. RNA는 DNA보다 불안정하고 복제과정에서 RNA에 돌연변이 빈도가 훨씬 자주 일어난다. 돌연변이는 모든 생명체에서 일어나는 자연현상팬데믹을 일으키는 바이러스는 대부분 RNA 바이러스이다. 사스코로나바이러스-2, 인플루엔자, 에이즈 바이러스 등이 이에 속한다. DNA 중합 효소와는 달리 RNA 중합 효소(RNA 중합효소는 DNA 혹은 RNA 주형으로 RNA를 합성하며, DNA 중합효소는 DNA를 주형으로 새 DNA를 복제한다)는 유전체를 복사할 때 교정, 판독 과정을 거치지 않기 때문에 1000~100,000개 염기 당 1개의 비율로 에러를 일으킨다. DNA 중합 효소보다 약 1,000배 이상 에러 확률이 높다. 사스코로나바이러스-2 유전체는 약 30,000개 염기로 이루어져 있으므로, 대략 3개의 바이러스가 생산될 때마다 1개의 돌연변이가 생긴다. 돌연변이는 모든 생명체에서 일어나는 자연현상이며 진화의 원동력이다. 바이러스에서 빈번하게 일어나는 돌연변이는 바이러스 생활사의 지극히 자연스러운 삶의 한 부분일 뿐이다. 돌연변이는 무작위로 일어나며, 돌연변이체 중에서 환경에 가장 잘 적응하는 개체가 선택적으로 살아남는다. 가령 돌연변이로 바이러스가 숙주 세포로 더 효율적으로 침입할 수 있거나 숙주의 면역작용을 회피할 수 있다면, 이는 바이러스 생존에 유리할 것이다. 그러나 돌연변이로 바이러스 독성이 약화되는 사례도 많다. 바이러스 생존에 불리한 변이 역시 종종 발생한다. 17개 염기서열 변이가 아미노산 변화에 영향B117은 이미 2020년 9월에 런던, 켄트 지역에서 처음 보고되었으며 11월 중순에 런던과 영국 남동부 지역 환자의 약 30%에서 발견되고 있다. 사스코로나바이러스-2에서는 자연적으로 월 평균 2개의 염기가 치환되는 돌연변이가 축적되어 왔다. 변이 부위는 사스코로나바이러스-2 유전체에 무작위로 분포하고 있다. B117 변이체는 우한 바이러스와 비교해서 30,000개 염기 중에서 29개가 다르다. 이 중 23개 염기가 2~3개월 만에 바뀌었다는 점이 이례적이다. 그럼에도 불구하고 B117은 변종이 아닌 ‘변이체’로 불러야 한다. 변종으로 분류되려면 이전의 버전과는 확연히 차이가 나는 독특한 속성과 면역적 차별성을 지녀야 한다. 23개 돌연변이 중에서 6개는 아미노산 서열에 영향을 주지 않는 침묵 돌연변이다. COVID-19 Genomics Consortium 보고서(COG-UK 2020; Rambaut et al., 2020)에 의하면 나머지 17개는 특정 코돈이 판독될 때 아미노산이 결실되거나 다른 아미노산으로 바뀌게 하여 단백질의 구조를 변화시키는 돌연변이다. 코돈은 유전암호의 단위로 mRNA의 염기 A,G,C,U 중 3개 묶음으로 이뤄진다. 이 묶음 단위가 단백질을 합성하는 단위분자인 아미노산을 생산하는 정보를 제공하므로 유전암호라 불린다. 이 변이체는 주요 유전자인 오픈리딩프레임(ORF)1a 및 ORF1b 영역에서 3개의 아미노산이 변경되었다. 아울러 스파이크(S) 단백질에서 2개의 아미노산 결실 및 6개의 변경이 일어났고, ORF8에서 3개, 뉴클레오타이드(N) 단백질에서 아미노산 2개가 각각 변경되었다(그림 1, 표 1). 기존에 미국에서 보고되었던 D614G 돌연변이는 B117에서도 나타나므로 B117 변이체는 G형에서 파생한 것으로 추정된다.
스파이크 단백질 변이에 주목하는 과학자들과학자들은 바이러스 변이체 중 스파이크 단백질에 생기는 돌연변이에 주목한다. 바이러스 표면에 돌기 형태로 발현하는 스파이크 단백질은 숙주 세포 수용체인 ACE2와 결합해서 침입하는 데 필수적이기 때문이다. 접종 중이거나 개발 중인 백신 대부분이 스파이크 단백질을 무력화하는 중화항체를 유도하도록 설계된 이유다. 아미노산 N501Y 돌연변이는 인간 ACE2 수용체와 결합하는 스파이크의 맨 끝 부위에 발생한다(그림 1). 결실 중 하나(69-70 결실)는 스파이크 단백질의 구조 변화를 통해 면역반응을 회피하는 데 관여하는 것으로 추정된다. 그리고 P681H 변이는 코로나바이러스에서 가장 가변성이 높은 "퓨린 절단" 부위 바로 옆에 위치한다. 이 부위는 바이러스가 인간 세포로 들어가는 과정에서 핵심역할을 하는 것으로 알려져 있다. 영국에서 B117 변이체가 발견된 시점에 남아프리카공화국에서도 독립적으로 스파이크 유전자에서 8개의 돌연변이를 발견했다. 그중 3개 (K417N, E484K 및 N501Y)는 ACE2 수용체와의 결합에서 기능적 역할을 할 것으로 추정된다(Tegally et al., 2020). N501Y은 흥미롭게도 영국의 B117에서도 발견되는데, 이는 N501Y가 바이러스에 선택적 이점으로 작용할 수 있다는 가능성을 제시한다. B117 변이체는 덴마크, 네덜란드, 오스트레일리아, 미국, 캐나다, 한국 등 30여 개국에서도 발견되고 있다. 변이체 독성은 약화되었을 가능성 높아모든 관심이 백신의 타깃인 스파이크 단백질에 나타난 돌연변이에 집중되고 있다. 그러나 ORF8 유전자에 발생한 변이에도 주목해야 한다. ORF8이 해독되면 76개의 아미노산으로 이루어진 외피 단백질(envelope protein)이 합성된다. 사스코로나바이러스-2의 외피 단백질은 바이러스 독성을 결정하는 인자이다. 외피 단백질이 손실되면 코로나바이러스는 독성이 약화된다(DeDiego et al., 2007). 이 때문에 바이러스 외피 단백질을 표적으로 한 치료제 개발이 시도되고 있다. B117 변이체의 외피 단백질에서 Q27정지, R52I, Y73C 아미노산 부위에 변이가 일어났다. 이중 특히 Q27정지 변이가 흥미롭다. 27번째 아미노산 위치에서 외피 단백질 합성이 멈췄기 때문이다. 또한 외피 단백질의 C 말단으로부터 4개의 아미노산(73-76번)은 다양한 염증 관련 숙주 단백질들과 결합하는 데 관여한다. 4개의 아미노산 서열이 바뀌면 결합하는 염증 단백질의 종류가 바뀌고 염증반응의 성격이 달라져서 독성에 영향을 준다. 그러므로 B117 변이체의 Y73C 돌연변이도 독성에 영향을 줄 것으로 예상된다. 결론적으로 B117 바이러스는 Q27정지와 Y73C 돌연변이 때문에 독성이 약화되었을 가능성이 높다. 영국 변이체 출현의 세 가지 가능성바이러스 유전체가 복사되면서 자연적으로 매달 1~2개의 돌연변이가 사스코로나바이러스-2에 점진적으로 누적된다. 영국에서 발견된 B117에서는 갑자기 23개의 돌연변이가 군집으로 발생했다. 특히 돌연변이가 스파이크 유전자와 외피 단백질을 암호화하는 ORF8에 집중되어 예사롭지 않다. 따라서, 이 변이체는 점진적인 돌연변이 축적을 통해 출현하지 않았음을 시사한다. 사스코로나바이러스-2 바이러스 유전체 총 길이가 30,000 염기(100%)이고, 이중 스파이크 유전자와 ORF8 길이는 4100 염기(13%) 이므로 이론적으로는 23개 중에서 약 3개의 염기 돌연변이가 이 지역에 위치해야 한다. 23개 돌연변이 중에서 침묵 돌연변이 6개를 제외하고, 실제 아마노산 변화를 일으킨 돌연변이 17개 중에서 64%인 11개가 스파이크와 ORF8에 위치한다. 이 돌연변이는 아직 백신 접종이 이루어지지 않은 시기에 발생했으므로, 지속적인 예방 접종 프로그램의 선택 압력을 통해 나타났을 가능성은 없다. 이에 대해서는 3가지 가능성을 생각해볼 수 있다. 첫째, 면역 체계가 약화된 만성질환자들이 바이러스 돌연변이의 생산기지 역할을 하면서 슈퍼전파자가 되었을 수 있다. 슈퍼전파자란 주로 고령의 기저질환이 있는 감염자로, 면역 체계가 망가져 고농도의 바이러스를 보유하게 되어 많은 사람에게 감염을 일으키는 사람이다. 건강한 사람이 감염되면 일반적으로 바이러스가 한 번 복제하면서 몸 밖으로 빠져 나간다. 바이러스 자손에게 계속 전달될 수 있는 의미 있는 돌연변이가 확립되기 어렵다. 하지만 면역이 약화된 환자에서는 코로나바이러스가 수개월 동안 머무르며 복제를 거듭하면서 연속적으로 돌연변이를 일으킨다. 장기간 감염은 면역회피 돌연변이의 축적을 빠르게 초래할 수 있다. 실제로 사망 전 거의 5개월 동안 감염되고 면역이 떨어진 45세 남성 사례에서 바이러스 돌연변이가 가속화되는 것이 보고되었다(Choi et al., 2020). 바이러스 치료법을 지속해서 사용하면 선택압(생물들이 해당 서식처에 살아남도록 하는 압력)으로 작용해서 바이러스가 돌연변이가 촉진된다. 실제로 코로나19 중증 환자에 사용하는 혈장 치료법이나 렘데시비르를 장기적으로 투여한 환자에서는 돌연변이가 더 빈번하게 일어난다. 항바이러스제 및 항체 요법과 같은 신약이 오히려 바이러스 변종의 출현에 이바지하기 때문에 의료계는 이러한 치료 옵션을 신중하게 사용한다. 둘째, 사스코로나바이러스-2가 인간에서 다른 동물로 감염되었다가 인간에게 재감염되었을 가능성이다. 이 경우 단기간에 군집 돌연변이가 발생할 수 있다. 이런 위험성 때문에 세계 최대 밍크 모피 생산국인 덴마크에서는 수백만 마리의 밍크를 살처분했다. 실제 덴마크에서는 밍크들 간에 사스코로나바이러스-2가 전파되는 동안 다중 스파이크 단백질 돌연변이(RBD 돌연변이 Y453F 및 결실 69-70 포함)를 가진 변이체가 출현했다(Laussauniere et al., 2020). 밍크와 관련된 몇 가지 다른 스파이크 단백질 돌연변이는 네덜란드에서도 보고되었다(Oude Munnink et al., 2020). 셋째, 국가 간 유입 가능성이다. 즉 바이러스 유전체 샘플 수집과 해독률이 매우 낮은 국가에서 바이러스 변화 과정을 알아채지 못해 B117 변이체가 폭넓게 전파된 이후, 영국 런던과 남동부 지역으로 유입되었을 가능성도 있다. 영국은 세계에서 가장 크고 뛰어난 유전체 분석 및 추적 시스템을 보유하고 있다. 반면에 영국은 결국 실패로 끝난 집단면역 의존 방역 정책과 시민들의 느슨한 방역 의식 등으로 사스코로나바이러스-2 대확산을 자초한 면도 있다. 코로나19 바이러스 돌연변이의 계보코로나19 바이러스는 전 세계를 휩쓸면서 180만 명 이상의 사망자를 내고 인간 숙주에 적응하면서 여러 그룹으로 변이를 겪고 있다. 바이러스의 변이 과정을 추적하고 이해하는 것은 코로나19 질병의 대처 전략 개발에 중요하다. 전 세계에서 가장 큰 신종 코로나바이러스 게놈 서열 데이터베이스인 GISAID (Global Initiative on Sharing All influenza Data)의 185,000개 유전체 표본 분석에 따르면 현재 사스코로나바이러스-2에는 7가지 주요 계열이 존재한다(GISAID 2020). 유전자 염기서열 차이로 인한 아미노산의 변화를 기준으로 사스코로나바이러스-2를 S, V, L, G 형으로 구분하고, G형은 다시 GR, GH, GV로 세분화한다. 드물게 나타나는 기타 돌연변이들은 집합적으로 O형으로 분류한다. L은 우한에서 처음 등장한 원형이고, S, V는 약간 변이된 유전형으로서 중국 등 아시아 지역에서 주로 발견되었다. 현재는 G형이 전 세계적인 우세종으로 자리 잡았다(그림 2). G형에서 하나의 특정 돌연변이인 D614G가 가장 일반적인 변이체가 되었다(Korber et al., 2020). 사스코로나바이러스-2 스파이크 단백질의 614번째 위치의 아미노산이 D(아스파르트산)에서 G(글라이신)로 바뀌었기 때문에 이름이 붙여졌다. 앞서 언급했듯이 영국 변이체에서도 D614G 변이가 발견되어 G형에서 파생된 것으로 분류한다.
지금까지 사스코로나바이러스-2 변이체에 대한 이해와 출현 배경에 대해 살펴보았다. 이어지는 2편에서는 이 변이체가 기존 바이러스 보다 전파속도가 빠르고 독성이 강한지, 면역반응을 회피하고 백신을 무력화할 가능성이 있는지 등에 대해 좀 더 심화된 차원에서 검토해보고자 한다. ▣ 참고문헌Choi et al., Persistence and Evolution of SARS-CoV-2 in an Immunocompromised Host. N Engl J Med 2020; 383:2291-2293 COVID-19 Genomics UK Consortium (COG-UK) 2020. Available from: https://www.cogconsortium.uk/. European Centre for Disease Prevention and Control (ECDC). COVID-19 surveillance report. Week 50, 2020. Stockholm: ECDC. Available from: https://covid19-surveillancereport.ecdc.europa.eu/. GOV.UK. Speech: Prime Minister's statement on coronavirus (COVID-19): 2020 Available from: https://www.gov.uk/government/speeches/prime-ministers-statement-on-coronaviruscovid-19-19-december-2020. GISAID. 2020. Available from: https://www.gisaid.org/. Hoffmann, Markus, Hannah Kleine-Weber, and Stefan Pöhlmann. 2020. “A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells.” Molecular Cell 78: 779–84.e5. Korber et al., Spike mutation pipeline reveals the emergence of a more transmissible form of SARS-CoV-2. Cell 2020 182:812-827. Laussauniere et al., Working paper on SARS-CoV-2 spike mutations arising in Danish mink, their spread to humans and neutralization data. SARS-CoV-2 spike mutations arising in Danish mink and their spread to humans. Copenhagen: Statens Serum Institut; 2020. Available from: https://files.ssi.dk/Mink-cluster-5-shortreport_AFO2. Oude Munnink et al., Transmission of SARS-CoV-2 on mink farms between humans and mink and back to humans. Science. 2020:eabe5901. Peacock, Thomas P., Daniel H. Goldhill, Jie Zhou, Laury Baillon, Rebecca Frise, Olivia C. Swann, Ruthiran Kugathasan, et al. 2020. “The Furin Cleavage Site of SARS-CoV-2 Spike Protein Is a Key Determinant for Transmission due to Enhanced Replication in Airway Cells.” Cold Spring Harbor Laboratory. https://doi.org/10.1101/2020.09.30.318311 Rambaut et al., Preliminary genomic characterisation of an emergent SARS-CoV-2 lineage in the UK defined by a novel set of spike mutations: COVID-19 genomics UK consortium; 2020. Available from: https://virological.org/t/preliminary-genomic-characterisation-of-an-emergent-sars-cov-2-lineage-in-the-ukdefined-by-a-novel-set-of-spike-mutations/563. Starr, Tyler N., Allison J. Greaney, Sarah K. Hilton, Daniel Ellis, Katharine H. D. Crawford, Adam S. Dingens, Mary Jane Navarro, et al. 2020. “Deep Mutational Scanning of SARS-CoV-2 Receptor Binding Domain Reveals Constraints on Folding and ACE2 Binding.” Cell 182: 1295–1310.e20. Tegally et al., Emergence and rapid spread of a new SARS-CoV-2 lineage with multiple spike mutations in South Africa. medRxiv 2020 doi: https://doi.org/10.1101/2020.12.21.20248640. Volz et al. Evaluating the Effects of SARS-CoV-2 Spike Mutation D614G on Transmissibility and Pathogenicity. Cell. 2020. doi:10.1016/j.cell.2020.11.020. 글 | 안광석 기초과학연구원(IBS) RNA 연구단 연구위원‧서울대 생명과학부 교수(바이러스면역학) 편집 | IBS 커뮤니케이션팀 발행일 | 2021년 1월 12일 본 글의 저작권은 기초과학연구원에 있습니다. 무단 전재를 금지하며 공유, 인용 및 재사용 시에는 출처를 명시해주시기 바랍니다. |
| 다음 |
|---|
- 콘텐츠담당자
- :
- 최종수정일 2023-11-28 14:20











![그림2. 사스코로나바이러스-2 돌연변이 추이 사스코로나바이러스 돌연변이 추이를 나타내는 그래프이다.
유형변화 [L S O V G GR GH GV]
1월에는 우한 L형, 11월에는 모두 G형에 가깝다.](https://www.ibs.re.kr:443/dext5data/2021/01/20210112_161338596_46690.png)

