연구원소개
연구원소개
| 제목 | 벌개미취, 더덕 등 자생식물서 천연 항바이러스 물질 발견 | ||
|---|---|---|---|
| 보도일 | 2022-11-09 10:34 | 조회 | 239 |
| 보도자료 |
![pdf 파일명 : 221109_[IBS 보도자료] 벌개미취 더덕 등 자생식물서 천연 항바이러스 물질 발견(즉시).pdf](/images/mimetype/pdf.gif) 221109_[IBS 보도자료] 벌개미취 더덕 등 자생식물서 천연 항바이러스 물질 발견(즉시).pdf
221109_[IBS 보도자료] 벌개미취 더덕 등 자생식물서 천연 항바이러스 물질 발견(즉시).pdf
|
||
| 첨부 |
![zip 파일명 : 221109_[IBS 보도자료] 그림 사진 및 영상.zip](/images/mimetype/zip.gif) 221109_[IBS 보도자료] 그림 사진 및 영상.zip
221109_[IBS 보도자료] 그림 사진 및 영상.zip
|
||
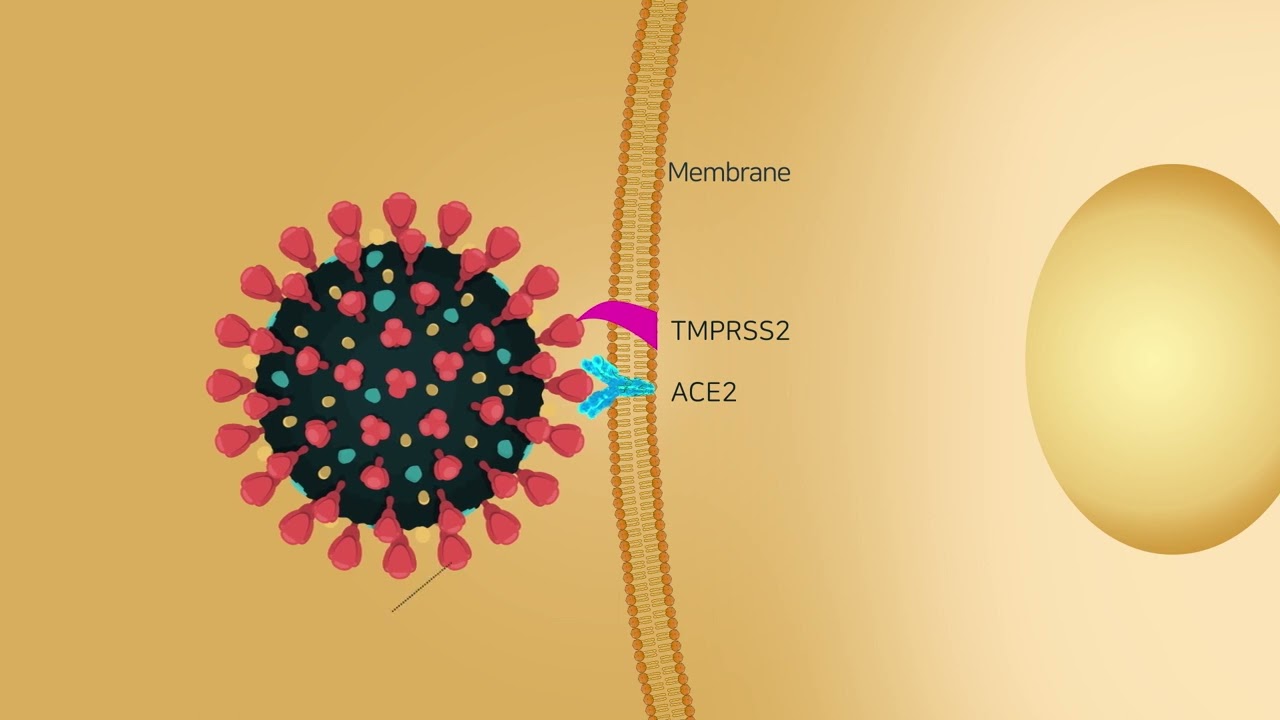
벌개미취, 더덕 등 자생식물서 천연 항바이러스 물질 발견- IBS, 코로나바이러스 감염 경로 차단하는 사포닌 작동 원리 규명 - - 감염 억제 효과 2배 높인 인공화합물 합성도 성공...범용 항바이러스 치료제 개발 기대 - 우리 자생식물인 벌개미취(Aster koraiensis Nakai, 고려쑥부쟁이)와 더덕(Codonopsis lanceolata Trautv)의 항바이러스 효과가 확인됐다. 기초과학연구원(IBS, 원장 노도영) 생명과학 연구클러스터 이창준 소장(인지 및 사회성 연구단 단장) 연구팀은 벌개미취에 함유된 ‘아스터사포닌 I(Astersaponin I)’과 더덕에 함유된 ‘란세마사이드 A(Lancemaside A)’사포닌이 코로나바이러스의 세포 내 침입 경로인 세포막 융합을 막아 감염을 억제한다는 사실을 새롭게 규명했다. 벌개미취는 국화과에 속하는 다년생식물로 우리나라에서만 자라는 한반도 고유식물이다. 더덕은 초롱꽃과에 속하는 다년생덩굴식물로서 우리나라 전역의 산과 들에서 자라고 있으며, 도라지에 이어 우리나라에서 두 번째로 많이 재배하는 산채류이다. 코로나바이러스 입자는 엔도좀(endosome)1)이나 세포표면 형질막과 융합한 형태로 인체세포 내로 들어오게 된다. 이 두 경로는 공통적으로 코로나바이러스 외피막과 인체세포 세포막 사이의 ‘막 융합’과정을 필수적으로 거치게 된다. 연구진은 아스터사포닌 I과 란세마사이드 A가 이러한 코로나바이러스와 인체세포간 막 융합을 막아 코로나바이러스 세포 내 감염경로를 모두 차단한다는 사실을 밝혔다. 연구진은 생물안전 2등급 연구시설에서 실험할 수 있는 코로나바이러스 스파이크 단백질을 표면에 발현한 슈도바이러스(psuedovirus)2)와 인간 폐세포를 이용하여 코로나 바이러스 감염모델을 만들고, 아스터사포닌 I과 란세마사이드 A를 처리하여 바이러스 세포 침임 억제 효과를 확인했다. 그 결과, 두 사포닌 모두 약물의 생물학적 기능 억제 효능을 나타내는 IC50값3) (반수 최대 억제 농도, half maximal inhibitory concentration)이 2μM(마이크로몰) 수준으로 코로나바이러스 세포 진입 경로를 효과적으로 억제했다. 살아있는 감염성 코로나바이러스를 이용한 실험에서도 동일한 결과를 확인했으며, 초기 코로나바이러스뿐만 아니라 오미크론 등 변이코로나바이러스에 대해서도 거의 동일한 효율로 감염을 억제했다. 아스터사포닌 I과 란세마사이드 A는 중앙골격구조가 세포막의 주요구성물질인 콜레스테롤과 매우 유사하고 한쪽에 길게 당이 붙어 있는 구조다. 세포막이 콜레스테롤과 유사한 이들 사포닌의 중앙부를 세포막 안으로 받아들이고 한쪽에 길게 붙어있는 당 부위가 세포막 밖으로 돌출되면, 이 돌출된 부분이 코로나바이러스 외피막과의 막융합을 가로막는 것이다. 오미크론 등 변이 코로나바이러스는 스파이크 단백질의 돌연변이 때문에 세포수용체 ACE2와의 결합력이 높아져 세포감염이 잘된다. 그러나 스파이크 단백질의 결합력이 강해져도 결합 이후 막 융합 과정이 막히면 코로나바이러스는 세포 내로 들어올 수 없다. 즉, 막 융합 저해물질은 바이러스와 세포수용체의 결합력에 상관없이 바이러스 감염을 효과적으로 막을 수 있다. 연구결과는 국제학술지 ‘항바이러스 연구(Antiviral Research)’ 10월 온라인판 및 ‘항균제 및 화학요법(Antimicrobial Agents and Chemotherapy)’ 11월 온라인판에 각각 게재됐다. 해당 연구에는 경희대학교 약학대학교 장대식 교수 및 한국 파스퇴르 연구소 김승택 박사 연구팀이 공동으로 참여했다. 또한, 연구진은 이번 연구에 앞서 한국 파스퇴르 연구소 김승택 박사 연구팀과 도라지 사포닌인 ‘플라티코딘 D(Platycodin D)’의 항 코로나 활성을 규명한 바 있다.(2021년 5월 실험분자의학(Experimental & Molecular Medicine) 발표) 흥미로운 것은 아스터사포닌 I, 란세마사이드 A 및 플라티코딘 D 모두‘트라이터페노이드 사포닌(Triterpenoid saponin)’에 속하며, 한쪽에 길게 당이 붙어 있는 비슷한 화학 구조를 가지고 있다는 사실이다. 연구진은 트라이터페노이드 사포닌에 붙어 있는 당이 코로나바이러스 감염 억제 활성에 중요하다는 결과에 착안, KAIST 화학과 한순규 교수 연구팀과 함께 당의 길이와 종류를 달리하는 10여종의 서로 다른 사포닌을 합성했다. 그 결과 자연에서 발견한 트라이터페노이드 사포닌인 플라티코딘 D보다 활성이 2배 높은 신규물질 합성에 성공했다. 이 연구는 국제학술지 ‘생유기화학(Bioorganic Chemistry)’ 10월호에 게재됐다. IBS 이창준 소장은 “벌개미취, 더덕, 도라지에 포함된 트라이터페노이드 사포닌은 일상에서 쉽게 접할 수 있는 식품 및 생약의 주요성분으로, 섭취 시 상기도의 상피세포에 고농도로 노출될 수 있어 무증상환자나 초기 환자에게 효과를 기대할 수 있다”고 밝혔다. “아직 세포실험 단계의 연구결과이지만 동물실험에서도 좋은 결과가 나온다면 임상실험도 가능할 것”이라고 밝혔다. 장대식 경희대 교수는 “중국의 경우, 중국전통의학연구원 투유유 교수가 개똥쑥에서 말라리아 치료제인 아르테미시닌을 개발한 공로로 2015년 노벨생리‧의학상을 수상한 이후 정부차원에서 중의약 연구에 전폭적인 지원을 해오고 있으나 우리나라의 경우 오히려 축소되고 있는 현실이 아쉽다”며, “이번 연구 결과 발표가 국내 자생 혹은 재배 식물을 활용한 의약품 개발 연구 분야의 활성화에 기여하길 기대한다”라고 전했다. IBS 김태영 선임연구원은 “천연물 유래 약재는 쉽게 구할 수 있고 오랫동안 사용되어 안정성이 입증된 장점이 있다. 역사적으로 페니실린, 아스피린, 말라리아 치료제 성분인 아르테미시닌 등이 천연물질에서 유래됐다”며, “막융합 저해제는 코로나바이러스와 같은 외피막 바이러스의 감염을 범용적으로 차단할 수 있으므로, 범용 항바이러스 치료제 개발의 가능성을 제시했다” 밝혔다. 그림 설명
영상 설명
1) 엔도좀(endosome)은 세포가 외부 물질을 세포막을 통해 흡수하는 ‘세포 내 이입(endocytosis)’으로 생성된 세포 내 소포(vesicles)로, 물질 이동에 관여한다. 2) 스스로 복제할 수 없도록 하여 병원성을 제거한 유사바이러스로, 연구를 위해 코로나바이러스 스파이크 단백질을 바이러스 외피막에 발현하도록 하여 세포진입 단계만 모니터링 할 수 있도록 했다. 3) 특정 생물학적 또는 생화학적 기능을 50% 억제하는데 필요한 약물의 농도 |
|||
| 다음 | |
|---|---|
| 이전 |
- 콘텐츠담당자
- 홍보팀 : 임지엽 042-878-8173
- 최종수정일 2023-11-28 14:20











![[그림 1] 우리나라 자생식물인 벌개미취와 더덕](https://www.ibs.re.kr:443/dext5data/2022/11/20221109_102702539_36762.png)
![[그림 2] 코로나바이러스 및 오미크론을 포함한 변이바이러스에 대한 벌개미취 아스터사포닌 I의 감염저해효과 아스터사포닌 I이 초기 코로나바이러스 및 오미크론을 포함한 변이바이러스에 대한 IC50 값이 2μM 근처에서 나타나며, 동일한 효율로 감염을 차단하는 것을 알 수 있다. 이는 아스터사포닌 I이 바이러스 외피와 인체세포간의 막 융합을 막는 작용기작 때문에 가능하다.](https://www.ibs.re.kr:443/dext5data/2022/11/20221109_102851801_75693_r.jpg)
![[그림 3] 더덕에서 분리한 란세마사이드 A의 코로나바이러스 외피막 융합 저해 활성
코로나바이러스는 바이러스 외피와 인체세포막 간의 막 융합을 통해 세포 안으로 들어온다. 코로나바이러스 스파이크 단백질을 표면에 발현한 세포(녹색형광염색)를 인간 폐세포(적색형광염색)와 배양하면 두 세포 간의 막 융합에 이은 세포 융합을 관찰할 수 있다. 란세마사이드 A는 이러한 막 융합을 억제하여 코로나바이러스의 세포 내 감염을 차단하게 된다.](https://www.ibs.re.kr:443/dext5data/2022/11/20221109_102753122_20697_r.jpg)
![[그림 4] 트라이터페노이드 사포닌에 의한 코로나바이러스 감염경로 차단 원리
아스터사포닌 I, 란세마사이드 A, 플라티코딘 D를 포함한 트라이터세노이드 사포닌은 중앙골격구조가 콜레스테롤과 매우 유사하여 세포막 안에 위치할 수 있게 된다. 한쪽에 붙어 있는 당쇄가 세포막 밖으로 돌출되고, 이 부위가 인체세포의 세포막과 코로나바이러스 외피막과의 막 융합을 저해하여 코로나바이러스의 세포 내 감염을 차단하게 된다.](https://www.ibs.re.kr:443/dext5data/2022/11/20221109_103059375_03898.png)
![[그림 5] 사포닌 유도체의 합성
(좌측) 도라지 사포닌 플라티코딘 D를 기반으로 12종의 사포닌 유도체를 합성했으며, (우측) 플라티코딘 D 보다 항코로나바이러스 활성이 2배 향상된 합성 사포닌 합성](https://www.ibs.re.kr:443/dext5data/2022/11/20221109_103151558_81770_r.jpg)