 뉴스센터
뉴스센터
| 제목 | 인공 세포 소기관으로 조직 깊은 곳 세포까지 에너지 공급한다 | ||
|---|---|---|---|
| 보도일 | 2021-09-13 11:25 | 조회 | 7473 |
| 연구단명 |
첨단연성물질 연구단 |
||
| 보도자료 |
![hwp 파일명 : 210914_[IBS 보도자료]인공 세포 소기관으로 조직 깊은 곳 세포까지 에너지 공급한다(첨단연성물질연구단,Nature Catalysi.hwp](/images/mimetype/hwp.gif) 210914_[IBS 보도자료]인공 세포 소기관으로 조직 깊은 곳 세포까지 에너지 공급한다(첨단연성물질연구단,Nature Catalysi.hwp
210914_[IBS 보도자료]인공 세포 소기관으로 조직 깊은 곳 세포까지 에너지 공급한다(첨단연성물질연구단,Nature Catalysi.hwp
|
||
| 첨부 | |||
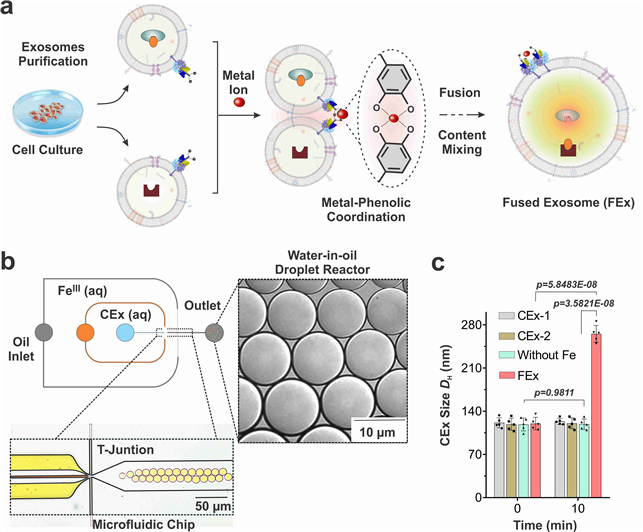
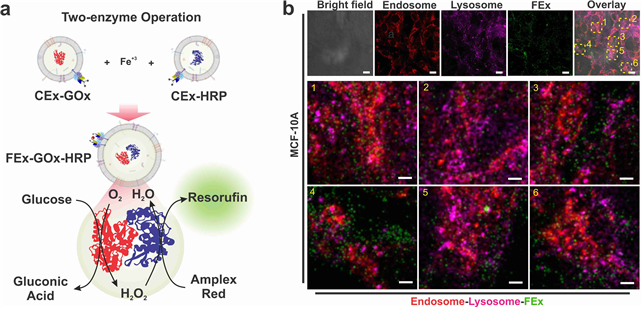
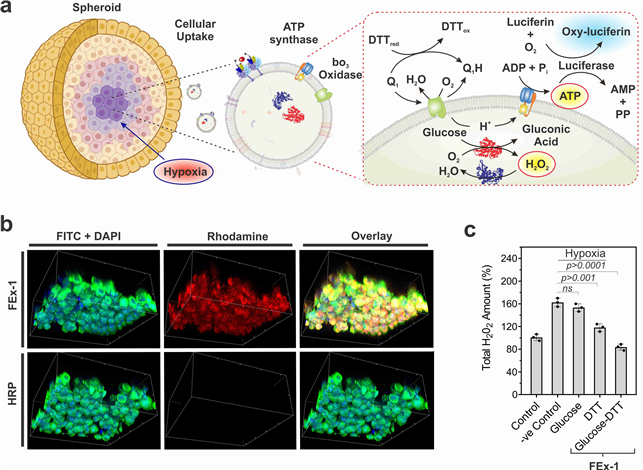
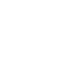
인공 세포 소기관으로 조직 깊은 곳 세포까지 에너지 공급한다- IBS 첨단연성물질 연구단, 엑소좀 융합으로 인공 세포 소기관 개발 - - 손상 세포에 에너지를 공급하는 등 새로운 약물 전달 시스템 제시 - 생명현상에 대한 이해가 확장되면서 단순한 관찰 수준을 넘어서는 인공적 재현 시도가 주목받고 있다. 최근에는 인위적으로 세포 소기관(artificial organelles)을 만들어 생체 촉매 반응을 모사하려는 시도도 이루어지고 있다. 세포 소기관은 세포의 ‘장기’라 할 수 있는데, 세포호흡을 담당하는 미토콘드리아, 세포 내 소화기관 리소좀 등이 대표적이다. 이 기관에는 복잡한 생화학 반응을 수행하는 미세 공간들이 나누어져 있고, 그 내부에는 중요한 세포 기능을 함께 실행하는 여러 효소들이 존재한다. 다만 살아있는 세포에 인공 세포 소기관을 적용하려면, 세포 내 물질 전달 효율, 안정성, 생체적합성 등 해결해야 할 난제가 많다. 기초과학연구원(IBS, 원장 노도영) 첨단연성물질 연구단(단장 스티브 그래닉) 조윤경 그룹리더(UNIST 바이오메디컬 공학과 교수) 연구진은 살아있는 세포 간 정보전달체 엑소좀(exosome, 세포외소포체)1) 을 리프로그래밍하여 세포 내에서 에너지 생성이 가능한 인공 세포 소기관을 개발했다. 엑소좀은 조직 깊은 곳까지 침투할 수 있어, 기존 한계를 뛰어 넘는 새로운 약물 전달 시스템을 제시할 것으로 기대된다. 연구팀은 나노 크기 엑소좀이 살아있는 세포 간 효율적 정보전달체임에 착안했다. 이에 세포 크기의(직경 ~ 10 μm, 부피 1 picoliter 이하) 액적 기반 미세유체 반응기2) 를 이용, 두 종류의 엑소좀이 합쳐지면서 내부 물질끼리 화학반응이 일어나 융합되는 것을 확인했다. 또한, 엑소좀 내부 및 막단백질에 서로 다른 효소를 갖고 있는 엑소좀의 융합 반응을 통하여 생촉매 반응을 성공적으로 제어했다. 특히 이번에 개발한 인공 엑소좀은 의학적 활용 가능성도 클 것으로 기대된다. 연구진은 세포의 에너지 원천인 생체에너지(ATP)를 합성시킬 수 있는 효소들을 인공 엑소좀에 포함시켜, 살아있는 세포 내에서 ATP를 만들어내는 인공 합성 엑소좀의 생성을 확인했다. 나아가 인공 엑소좀이 유방암 모사 스페로이드의 내부 깊숙한 부분까지 전달되었음도 보였다. 이로써 인공 엑소좀이 저산소증으로 손상된 세포에 에너지를 공급하는 나노 알약으로 활용될 가능성을 보였고, 종양 중심부의 생체에너지(ATP) 부족 현상 규명에도 새로운 전략을 제시할 것으로 기대된다. 연구를 이끈 조윤경 그룹리더은 “인공 엑소좀을 통해 살아있는 세포에 보다 효율적인 물질 전달 방법을 제시했다”며 “향후 엑소좀의 내부와 표면에 부가적인 기능을 탑재한 인공 세포 소기관을 만드는 연구를 계속할 예정이다”라고 말했다. 연구결과는 나노분야 세계적 학술지인 네이처 카탈리시스(Nature Catalysis, IF 41.813)에 표지논문으로 9월 14일 0시(한국시간) 게재됐다. 그림설명
1) 엑소좀(exosome): 세포가 분비하는 세포 간의 신호전달 물질이다. 지름 50~200 nm의 세포 외 소포체의 한 종류로 단백질, 지질, 핵산 등 다양한 생체활성물질을 포함하고 있다. 2) 액적 기반 미세 유체 반응기(Droplet-based Microfluidic Reactors): 물과 기름과 같이 서로 섞이지 않는 두 유체를 이용하여 미세유체 칩 상에 여러 개의 액적(droplet)을 형성하고, 이렇게 상호 분리된 구역을 갖는 여러 개의 작은 액적(피코리터 수준 부피)들을 생화학 반응기로 활용하여 새로운 기능성 재료를 합성이나 생체물질의 고민감도 분석 등 다양한 응용 분야에 활용되고 있다. |
|||
|
|
|||
| 다음 | |
|---|---|
| 이전 |
- 콘텐츠담당자
- 홍보팀 : 나희정 042-878-8155
- 최종수정일 2023-11-28 14:20