기초과학의 미래를꿈꾸다
IBS 복잡계 자기조립 연구단의 그룹리더 김원종 포스텍 교수
자기조립 나노물질로 항암치료 신기원 연다
▲ "자기조립에 의해 만든 나노물질로 암 같은 난치병을 치료하는 것이 목표"라고 말하는 김원종 포스텍 교수. 김 교수는 IBS 복잡계 자기조립 연구단의 바이오 그룹에서 그룹리더를 맡고 있다.
"항암 치료는 인류가 수명을 연장하려면 극복해야 할 과제입니다. 새로운 항암제를 많이 만들기는 힘드니까 기존 항암제를 어떻게 활용할지 고민해야 합니다. 항암제의 부작용을 줄이고 약효를 높이기 위해 화학 및 재료 과학 측면에서 연구하고 있습니다."
IBS 복잡계 자기조립 연구단은 여러 구성 요소가 얽혀서 상호작용하는 자연현상, 특히 자기조립(self-assembly)과 관련된 복잡한 현상을 화학을 이용해 인공적으로 재현, 이해, 규명하려는 시도를 하고 있으며, 김원종 포스텍 화학과 교수는 이 연구단에서 자기조립에 의해 만든 나노물질을 바이오 분야에 응용하는 그룹의 리더를 맡고 있다.
최근 김원종 교수팀은 새로운 종류의 나노조립(nano-assembly)이나 DNA 나노구조체를 이용해 부작용이 적고 효과가 높은 항암치료 기술을 잇달아 개발했다. 항암치료 분야에서 잇달아 좋은 성과를 내며 주목받고 있는 김 교수를 포스텍 화학과 연구실에서 만났다.
의복부터 약물 전달체까지 모두 다 고분자!

▲ 포스텍 화학과 복도의 한쪽 벽에는 김원종 교수팀의 연구성과가 실린 논문들이 가득하다. 김 교수가 그중에서 금 나노입자와 DNA 나노구조체를 이용한 고효율 항암치료기술에 관한 논문에 대해 설명하고 있다.
"의복, 플라스틱, 사람의 몸이 모두 다 고분자로 이루어져 있습니다. 특히 우리 몸의 단백질, DNA는 생체 고분자로 구성돼 있는데, 생체재료를 이용해 인체에 약물을 전달할 수 있습니다."
한양대에서 섬유고분자공학을 전공했던 그는 일본 동경공업대에서 생체재료 분야로 공학 박사학위를 받았다. 생체재료에 대한 연구가 붐이 일던 당시에 일본에서 생체 고분자의 기초부터 응용까지 공부했던 것이다. 미국 유타대에서는 약대 김성완 교수의 연구실에서 박사후연구원으로 생체재료를 이용한 약물 및 유전자 전달 분야를 공부하고 연구했다. 김성완 교수는 이 분야의 세계적 권위자로 알려져 있다.
재료에서부터 약물 전달체까지 고분자의 다양한 분야를 섭렵한 김원종 교수는 IBS 연구단에서는 재료 과학 측면에서 고효율의 항암치료에 도전하고 있다. 암세포 주위는 혈관이 부실해 구멍이 많이 뚫려 있기 때문에 항암제를 넣으면 암세포에 많이 가게 되는데, 기존 항암제는 수동적인 전달에 그치기 때문에 암세포로 전달되는 효율이 낮고 암세포뿐 아니라 정상세포도 공격하는 게 문제다. 또 기존 항암제는 혈류 안에서 이동하다가 암세포에 도달하지 못하고 분해돼서 터지는 문제가 발생했다.
김 교수가 이끄는 연구팀은 기존 항암제의 문제를 능동적으로 해결할 수 있는 방법을 제시했다. "기존 항암제에 암세포를 찾아가 결합할 수 있는 특이 펩타이드를 붙이거나 크기를 조절해서 암세포에 많이 가게끔 능동적으로 타기팅을 합니다. 그리고 혈류 안에서 안정돼 오래도록 형태를 유지하다가 암세포 안으로 들어가면 그 안에서만 약물이 방출되도록 설계합니다."
주인-손님 상호작용, 금 나노입자로 항암치료
김 교수팀은 '강력한 주인-손님 상호작용(host-guest interaction)'을 이용해 효율 높은 표적형 항암 치료제 전달시스템을 개발해 '네이처 커뮤니케이션즈' 5월 8일자 온라인판에 발표했다. 즉 파클리탁셀(Paclitaxel)이란 항암제를 환상(環狀)구조의 올리고당인 싸이클로덱스트린(Cyclodextrin, CD)의 내부에 들어가는 주인-손님 상호작용을 이용한 것이다.
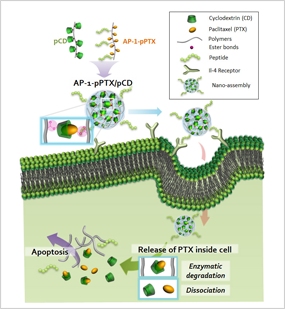
▲ 고분자화된 싸이클로덱스트린과 고분자화된 파클리탁셀 간의 주인-손님 상호작용으로 형성된 나노조립체는 암세포에 선택적으로 유입된 뒤, 산성 상태에서 분리되면서 약물이 방출돼 효율적으로 암세포를 사멸시킨다.
"파클리탁셀은 물에 잘 안 녹는데, 이 항암제를 잘 보니까 물에 잘 녹는 싸이클로덱스트린(CD 물질)에 쏙 들어가는 사실이 알려져 있었습니다. 파클리탁셀과 CD 물질 사이의 1 대 1 상호작용은 생각보다 약해서 여러 개를 각각 폴리머로 이어 붙여서 다자간 상호작용을 하게 했습니다. 그랬더니 굉장히 단단하고 안정한 나노조립구조가 탄생했습니다."
연구팀은 이 나노조립구조의 표면에다 암세포에 잘 결합해 들어갈 수 있는 펩타이드를 붙였다. 김 교수는 "암세포에 들어간 뒤에는 암세포에 있는 효소에 의해 그 구조가 끊어져 파클리탁셀이란 약물이 전달된다"며 "동물실험 결과, 암이 거의 사라졌다"고 말했다.
김 교수팀은 항암제 전달시스템의 크기에도 주목했다. 그는 "크기가 100~200nm로 일정하면 혈류 안에서 오래 순환할 수 있고 특이 펩타이드가 붙어 있으면 암세포에 갈 확률도 높아진다"며 "약효 지속력이 높고 부작용이 줄며 약효도 높아지게 된다"고 설명했다. 크기가 10nm 이하로 너무 작으면 암세포뿐 아니라 정상세포에도 가버린다고 한다.
또 김 교수팀은 DNA 나노구조체를 이용한 고효율 항암치료기술을 개발해 'ACS 나노' 9월 3일자 온라인판에 발표했다. 구체적으로는 금 나노입자에 pH 감응형 DNA와 상보적 결합을 하는 DNA, 치료유전자인 안티센스 DNA를 붙여 암세포만 찾아가는 지능적인 DNA 나노머신을 개발한 것이다.
연구팀은 i-motif라는 pH 감응형 DNA는 pH가 낮은 산성 조건에서 모양이 변형돼 분리되는 성질이 있다는 점에 착안을 했다. 크기 10nm 이하의 금 나노입자에 이 DNA의 상보적 서열을 붙여 몇 개가 뭉치게 했는데, 이렇게 형성된 클러스터는 크기가 100~200nm로 pH가 중성인 혈류 안을 순환하고 암세포에만 가게끔 된다. DNA 이중나선에는 독소루비신이라는 항암제를 담았고, 금 나노입자에는 암세포 치료유전자인 안티센스 DNA도 붙였다.
김 교수는 "이렇게 무장한 금 나노입자 클러스터가 암세포 안에 들어가면 산성으로 pH가 낮아지기 때문에 금 나노입자가 서로 풀리고 그 과정에서 약물과 치료유전자가 방출되는 것"이라며 "이중으로 암세포를 공격해 동물실험 결과 암세포가 거의 사라졌다"고 말했다.
최적화, 독성 극복, 그리고 기초 연구

▲ 김 교수가 한 연구원과 실험결과에 대해 논의하고 있다. 연구팀이 효율적인 항암제 전달시스템을 개발하기 위해서는 앞으로 최적화 과정과 다양한 동물실험을 거쳐야 한다.
최근 연구성과에 대해 세계의 관련 연구자들의 반응은 좋다. 김 교수는 "바이오, 화학 관련 분야의 연구자들은 아이디어가 참신하고 효과가 뛰어나다며 칭찬하는 한편, 앞으로 최적화하는 게 필요하다고 조언한다"고 밝혔다.
앞으로 김 교수팀의 연구성과가 임상 단계로 가려면 다양한 동물실험을 통해 최적화 과정과 보완 과정이 필요하다. 예를 들어 파클리탁셀과 CD 물질을 이용해 고효율의 항암제 시스템을 개발할 경우 각각을 붙이기 위한 폴리머 길이는 어느 정도여야 하는지, 하나의 폴리머에 얼마나 많이 붙여야 하는지 등에 대해 동물실험을 통해 최적화할 필요가 있다. 또 주인 물질과 손님 물질 간의 최적화, 새로운 폴리머 개발 등도 시도해야 한다.
그는 "DNA 나노구조체를 이용해 개발한 고효율 항암치료기술의 경우 금 나노입자의 독성을 극복하기 위해 계속 연구해야 한다"며 "금 나노입자는 단기적으로 독성을 보이지 않지만, 지속적으로 몸에 축적되면 잠재적 독성을 일으킬 우려가 있기 때문"이라고 설명했다.
최근 관련 분야의 핫이슈는 외부 자극에 의해 약물 방출을 제어하는 연구라고 한다. 즉 빛, 온도, 자성에 의해 항암제를 목적지로 끌고 가서 전달하는 연구를 말한다. 혈류를 통한 것이 화학적 타기팅인 것에 비해 자성 나노입자에 의한 것은 물리적 타기팅이다. 김 교수팀은 빛에 의해 크기가 조절되고 항암제가 방출되게 하는 연구성과에 대해 논문을 발표하기도 했다.
김 교수는 그룹리더로서 자기조립을 통해 구현한 독특할 물질을 생명공학, 생의학, 의약학에 응용하는 것이 목표이다. 그는 "자기조립 성질을 이용해 좀 더 복잡하고 창의적이며 고차원적인 물질을 만들어 약물 전달체, DNA 진단시스템 등을 개발하고, 결국 난치병을 치료하고자 한다"고 말했다. 물론 그러기 위해서는 IBS 연구단에 속한 다른 연구자들과 유기적으로 협력하는 기초 연구가 수반돼야 한다.