IBS 연구성과
3, 4월의 IBS 연구성과
1. 간단하고 빠른 방식의 그래핀 필름 제조법 신규 개발
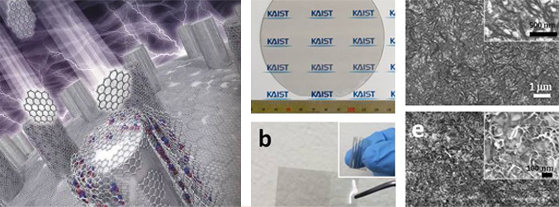
특별한 장치 없이 용액 속에 녹아있는 그래핀과 나노입자들이 계면에서 스스로 조립되어 큰 면적의 그래핀 필름을 형성하도록 유도하는 새로운 방법이 국내 연구진을 통해 개발돼 재료공한 분야 권위지인 '나노레터스(NANO LETTERS)'에 게재됐다.
기초과학연구원(IBS)의 나노물질 및 화학반응 연구단 김상욱 그룹리더팀(KAIST 교수)이 개발한 이번 성과는 그래핀 용액을 혼합한 물에 물과 일부 섞일 수 있는 휘발성 유기용매를 소량 첨가하여 증발시키는 매우 간단한 방법이다. 흔히 와인잔에 나타나는 '와인의 눈물'로 알려진 마랑고니 효과와 자연대류 현상을 동시에 발생시켜 10cm 지름 크기의 그래핀 필름을 형성하는 데 약 2분 정도밖에 소요되지 않는다.
이 방법은 특별히 고가의 장치를 필요로 하지 않고, 제조한 그래핀 필름의 후처리 과정에서도 별도의 분리공정이나 환원공정을 거치지 않아도 된다. 이 때문에 보다 간편하고 저렴하게 다양한 소재의 표면에 그래핀 필름을 위치시킬 수 있다는 장점이 있다.
또, 기존 나노두께의 필름 제조가 어려웠던 다양한 유기․무기 나노입자들의 단독 혹은 복합 필름 제조가 가능하고 필름 형성과정에서 그래핀에 금, 팔라듐 등의 금속 나노입자를 붙일 수 있어 다양한 특성을 갖는 나노박막의 제조 및 소재의 표면처리에 활용할 수 있다.

▲ (좌)IBS 나노물질 및 화학반응 연구단 김상욱 그룹리더, (우)심종원 연구원(제1저자)
2. 그래핀 기공에 철 원자 메워 2차원 금속박막 구현 성공

기초과학연구원(IBS) 나노구조물리연구단은 그룹리더인 마크 러멜리(Mark H. Rummeli) 성균관대 에너지과학과 교수가 그래핀에 형성된 기공의 내부에 철 원자를 이동시켜 2차원의 단일층 금속박막을 만드는 데 성공했다고 밝혔다.
연구진은 투과형 전자현미경(TEM, Transmission Electron Microscope)을 이용하여 그래핀에 기공을 만든 뒤 철 원자를 이동시켜 구멍을 메웠고, 이를 통해 철로 구성된 단일층 막을 만들어냈다. 이렇게 구현된 철 원자막은 지금까지 알려진 원자 간 간격과는 현저히 차이가 나며 3차원 구조(bulk)와는 다른 물성을 갖는다는 사실을 규명했다.
마크 러멜리 IBS 나노구조물리연구단 그룹리더는 "이번 성과는 3차원 구조로만 존재하던 금속 원자 배열을 독립된 2차원 구조로 구현했다는 것에 의의가 있다."고 전하며 "본 원자의 배열에서 이론적 결과치로 예상되는 급격한 자기 모멘트(magnetic moment)의 향상은 향후 전기적, 광학적, 자기적인 연구와 응용에 상당한 파급효과를 미치게 될 것으로 기대된다."고 밝혔다.
이번 연구 성과는 미국과학진흥협회(AAAS)에서 발간하는 세계 최고 권위의 과학저널 사이언스(Science, IF 31.027)에 3월 14일 자로 게재됐다.
3. RNA꼬리 측정기술 세계최초개발

기초과학연구원(IBS) RNA연구단 김빛내리 서울대 생명과학부 교수팀은 전령RNA의 꼬리의 길이와 염기서열을 분석하는 '꼬리서열분석법(TAIL-seq)'을 개발했다고 19일 밝혔다. 연구 결과는 셀 자매지인 '몰레큘러 셀'의 표지 논문으로 3월 20일 게재됐다.
전령RNA에는 염기 중 하나인 '아데닌'으로 구성된 꼬리가 붙어 있다. 이는 전령RNA가 쉽게 잘리지 않도록 보호하고 리보솜이 효율적으로 단백질을 합성할 수 있도록 돕는다. 꼬리를 분석할 수 있다면 전령
RNA가 하는 역할을 더욱 구체적으로 들여다볼 수 있게 된다.
그동안 전령RNA의 구조와 세포의 운명을 결정하는 꼬리를 분석하기 위한 연구는 세계적으로 계속돼 왔다. 하지만, 전령RNA의 양이 적은데다 꼬리가 아데닌 한 종류의 염기로만 구성돼 염기서열분석기에서 나오는 신호가 반복돼 분석이 어려웠다.
연구팀이 개발한 것은 이같은 한계점을 극복할 수 있는 새로운 꼬리서열분석법이다. 연구팀은 자궁경부암세포주와 생쥐 섬유아세포 내의 전령RNA 꼬리의 시작부분과 끝부분에 '어댑터'를 붙였다. 어댑터는 25쌍의 염기서열로, 염기서열분석기계가 꼬리부분을 정확하게 인식하도록 하는 역할을 한다. 그리고 꼬리를 정방향과 역방향으로 총 2번 읽도록 했다. 그 결과, 꼬리의 길이를 정확히 파악했을 뿐 아니라 꼬리 말단의 서열까지 확인하는 데 성공했다.
논문의 제1저자인 장혜식 박사는 "전령RNA의 꼬리는 원래 아데닌 200개 정도가 이어졌다고 예측됐는데 실제 측정 결과 60~70개로 훨씬 짧았고, 꼬리 말단에는 RNA를 구성하는 또 다른 염기인 우라실이나 구아닌이 관찰됐다"며 "앞으로 몇 가지 동물 개체와 질병 모델을 갖고 연구해 나갈 예정"이라고 밝혔다.
4. 초고속 대용량 바이오 분석칩 개발
서울대 전기정보공학부 권성훈 교수팀은 '미세 입자'를 이용한 '바이오 분석칩'을 개발해 이 같은 시간을 획기적으로 줄이는데 성공했다고 네이처 자매지인 '네이처 커뮤니케이션' 3월 17일자에 발표했다. 연구팀은 다양한 항암제를 흡수시킨 미세 입자들을 손 바닥만한 칩 위에 뿌려 '바이오 분석칩'을 만들었다. 미세 입자는 물컹물컹한 젤과 같은 소재로 이루어진 마이크로(μm·1μm는 10만분의 1m) 크기의 입자로, 하나의 바이오 물질을 흡수하고 방출할 수 있어 약물을 운반하는 역할을 한다. 칩 위에는 10만 개 가량의 아주 작은 공간이 있어 이들 미세 입자가 1개씩 들어가 자리를 잡게된다. 그리고 연구팀은 바이오 분석칩과 세포를 얇게 펴서 만든 '세포칩'을 붙여 반응을 확인했다. 칩 위의 미세 입자는 작은 공간 속에서 항암제를 방출해 세포와 반응했는데, 미세 입자에는 약물의 이름이 쓰여 있어 어떤 약물이 세포를 죽였는지 알아 볼 수 있었다.

결국 수많은 약물의 효과를 간단히 세포의 생존상태를 알아보는 것만으로 확인할 수 있다는 말이다. 권성훈 교수는 "이전에 10만 개의 신약 후보물질 바이오 어세이를 하기 위해서는 일일이 사람이 약물과 세포를 반응시키며 반복해 5개월 이상 걸렸는데, 이번에 개발한 칩으로 한 번에 최대 10만 개의 약물에 대한 반응을 32시간 만에 살펴볼 수 있어 신약개발시간이 획기적으로 단축된 셈"이라며 "약물에 대한 반응은 개인별로 다른 데, 세포칩을 바꾸어 실험하면 개인별 약물의 효과도 빠르게 분석할 수 있어 맞춤형 의약을 만들 수 있을 것"이라고 밝혔다.
5. 피부 부착형 차세대 웨어러블 나노소자 개발
기초과학연구원(IBS) 나노입자 연구단은 권성훈 서울대 전기정보 공학부 교수팀이 신약 개발 과정에 걸리는 시간과 비용을 획기적으로 감소시킬 수 있는 초고속 대용량 바이오 분석칩을 개발했다고 네이처 커뮤니케이션즈 3월 17일 자 온라인판에 밝혔다.
연구팀은 서로 다른 물질을 코드화된 미세입자 안에 삽입하고 이러한 미세입자들을 작은 칩 위에 자기조립 시키는 파티페팅(Partipetting)이라는 개념을 고안하였다. 이 방법을 이용하면 다양한 약물 후보 물질들이 조립된 바이오칩을 매우 싼 값에 쉽게 만들 수 있으며, 다양한 신약 후보 물질에 대한 반응 검증과 결과 분석 시간을 단축할 수 있다.
이번 연구는 다양한 원천 기술을 융합하여 매우 적은 시간과 비용으로 초고속 대용량 약물 검색을 할 수 있는 바이오 분석칩을 개발하기 위해 수행되었다. 연구팀은 개발에 성공한 바이오 분석칩으로 다양한 종류의 항암제 및 항암제 조합에 대한 세포 반응을 확인하였으며 초고속 복합 약물 검색 플랫폼으로서의 가능성을 검증하였다.
권 교수는 "이번에 개발한 바이오 분석칩은 신약 후보물질을 비롯하여 다양한 바이오 물질을 검색하는데 소모되는 시간과 비용을 획기적으로 감소시킬 수 있기 때문에, 한국 바이오산업의 성장을 촉진시키는데 기여할 수 있을 것"이라며 "다양한 학제간의 융합 연구를 통해 일궈낸 연구 성과라는 점에서 그 의미가 매우 크다"고 연구 의의를 밝혔다.
6. 종양 진단·치료 동시 가능한 '나노 수류탄' 세계 최초 개발
현택환 기초과학연구원(IBS) 나노입자연구단장과 나건 가톨릭대 생명공학과 교수 공동연구팀은 종양조직을 찾아내면 터지는 이른바 '나노 수류탄'을 개발해 화학분야 세계 최고학술지인 '미국화학회지(JACS)' 2일자 온라인판에 게재했다.
연구팀은 산화철의 특수한 성질에 주목했다. 산화철은 자기공명영상(MRI)을 촬영할 때 몸속을 잘 볼 수 있도록 도와주는 조영제의 주요 성분이다. 산화철을 지름이 10μm(마이크로 미터·1μm는 100만 분의 1m) 이하인 작은 나노입자로 만든 후 MRI를 촬영하면 입자가 뭉쳐있는 부위는 검게, 흩어져 있는 부위는 하얗게 빛이 난다.
연구팀은 산화철 나노입자들이 정상조직에서는 뭉쳐 있게, 종양조직에서는 흩어질 수 있게 해주는 새로운 '끈'을 개발했다. '산도 민감성 고분자'로 불리는 이 끈은 pH7로 중성인 정상조직에서는 단단한 형태를 유지하지만, pH6.5로 약산성인 종양조직에서는 풀어진다.
연구진은 이 끈으로 산화철 나노입자를 칭칭 감아 수류탄 모양으로 만들었다. 그 결과 수류탄이 종양조직을 만나면 풀어지고, 어두운 방에서 불이 켜지듯 산화철 나노입자들이 빛을 냈다.
더 나아가 연구팀은 나노수류탄에 '광감각제'도 담았다. 광감각제는 빛을 감지하면 활성산소를 발생시켜 종양세포를 무차별적으로 파괴한다. 수류탄이 종양조직을 만나 풀어져 산화철 나노입자가 자연스럽게 흩어지면서 낸 빛을 감지하는 순간 치료까지 이뤄지는 것이다.
연구팀이 실제 암환자의 조직을 이식한 생쥐에 나노수류탄을 주입한 결과 약물처리를 하지 않거나, 광감각제와 산화철 나노입자 중 하나만 주입한 생쥐에 비해 종양이 현저히 줄어드는 것을 확인했다.
나 교수는 "정밀한 생체지표인 pH를 이용해 초기 작은 종양도 쉽게 진단할 수 있다"며 "그동안 종양조직을 이루는 세포들이 약물에 각각 다른 반응을 보여 효과적인 치료법이 없었는데, 빛과 활성산소를 이용해 무차별적으로 종양조직을 제거할 수 있어 임상에 빠르게 적용될 것"이라고 밝혔다.