
- 기초과학연구원(IBS)은 코로나바이러스감염증-19(COVID-19‧이하 코로나19)와 코로나19의 원인인 사스-코로나바이러스-2(SARS-CoV-2 또는 2019-nCoV)에 대한 과학 지식과 최신연구 동향을 담은 <코로나19 과학 리포트>를 발행합니다. IBS 과학자들이 국내외 최신 연구동향과 과학적 이슈, 신종 바이러스 예방·진단·치료에 도움이 될 만한 연구진행 상황과 아이디어 등을 시민들과 공유하고자 합니다.
2019년 12월 하순. 중국 우한지역에서 원인불명 폐렴환자들이 늘어남에 따라 중국 질병예방통제센터(CCDC)와 의료진, 그리고 과학자들은 신속하게 신종 질병 대응연구팀을 구성했다. 대응팀은 환자의 기관지 폐포 세척액을 분석해 신종 코로나바이러스(2019-nCoV 또는 SARS-CoV-2)를 발견하고, 전자현미경 사진과 해독한 2019-nCoV의 유전체 서열 전체를 학계에 빠르게 발표했다(Lu et al., 2020; Wu et al., 2020; Zhou et al., 2020; Zhu et al., 2020). 최초 확진자가 발생한지 불과 한 달만의 일로, 이를 토대로 전 세계 과학자들이 많은 연구결과를 내놓고 있다.
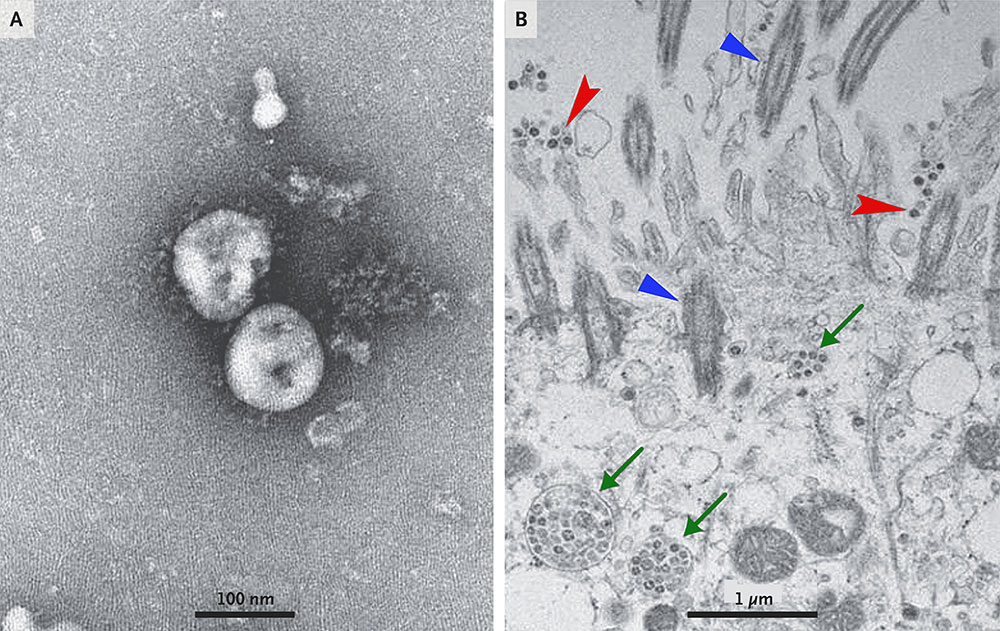
▲ 폐렴환자로부터 분리한 2019-nCoV를 투과전자현미경(TEM)으로 관찰한 이미지(A)와 2019-nCoV에 감염된 사람 호흡기 상피세포의 전자현미경 이미지(B). 섬모(파란색), 세포 외 바이러스입자(빨간색), 봉입체(바이러스 덩어리, 초록색)의 모습을 관찰할 수 있다. (출처: Zhu et al., 2020)
코로나바이러스는 계절유행성 감기를 유발하는 바이러스 중 하나다. 하지만 가볍게 여길 것은 결코 아니다. 그간 대규모 감염사태가 벌어졌던 2002년 사스(SARS‧중증급성호흡기증후군)와 2015년 메르스(MERS‧중동호흡기증후군)의 원인 역시 코로나바이러스였다. 이번에 발견된 2019-nCoV도 빠른 전파와 함께 심각한 호흡기증후군 증상을 나타내는 환자 수가 늘어나면서 전 세계적으로 큰 사회적 문제를 야기하고 있다.
스파이크단백질과 단백질가위 합작으로 침투
코로나바이러스를 투과전자현미경(TEM)으로 관찰하면, 바이러스 막 바깥쪽 표면에 돌기형태의 단백질(스파이크단백질)이 촘촘히 달려있는 구조를 볼 수 있다. 그 형태가 태양의 코로나와 비슷해 코로나바이러스라는 이름이 붙었다. 축구화 밑바닥의 스파이크가 미끄러짐을 방지하는 것처럼, 스파이크단백질은 숙주세포와 강하게 결합하여 바이러스가 숙주세포로 빠르게 침투하도록 지지해준다.
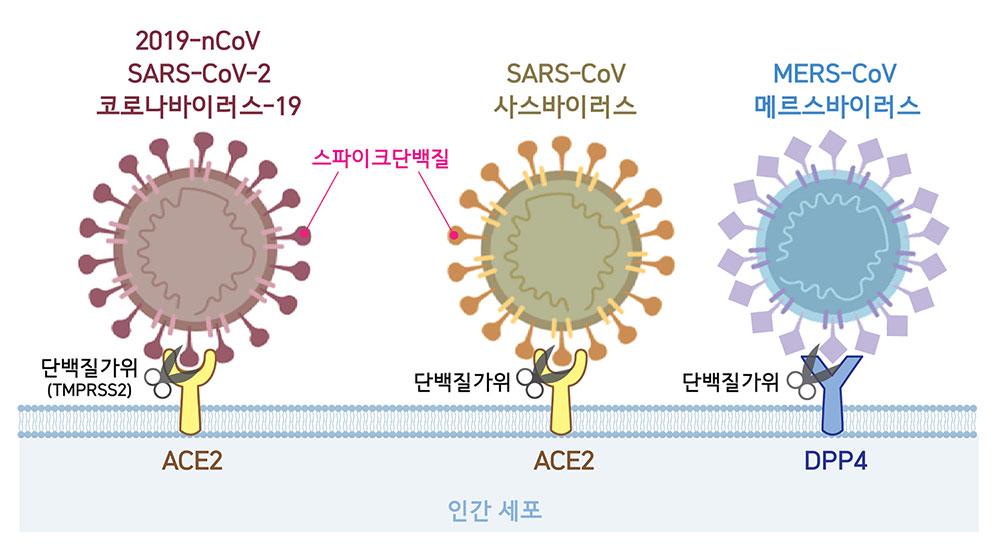
▲ 세포 속으로 침투하기 위한 첫 단계로 코로나바이러스는 표면에 위치한 스파이크단백질을 이용해 숙주세포의 수용체와 결합한다. 2019-nCoV와 사스바이러스는 ACE2를, 메르스바이러스는 DPP4를 수용체로 활용한다. 바이러스가 숙주세포와 결합하면 단백질가위(2019-nCoV의 경우 TMPRSS2)가 스파이크단백질의 일부분을 자르고, 비로소 바이러스가 세포 내로 침투한다.
공격과 수비 포지션에 따라 축구화 스파이크 개수와 모양이 다르듯, 사스바이러스와 메르스바이러스의 스파이크단백질 모양은 서로 다르다. 이 모양 차이로 인해 두 바이러스는 서로 다른 수용체를 활용해 숙주세포와 결합한다. 사스바이러스는 ‘ACE2(Angiotensin Converting Enzyme2)’, 메르스바이러스는 ‘DPP4(Dipeptidyl Peptidase4 또는 CD26)’를 수용체로 활용한다(Cui et al., 2019).
지난 2월 19일 극저온전자현미경(Cryo-EM) 분석을 통해 2019-nCoV의 입체 구조가 밝혀졌다. 3차원 분자구조 분석 결과 2019-nCoV와 사스바이러스의 스파이크단백질이 상당히 비슷한 형태를 가지고 있음이 확인됐다(Walls et al., 2020; Wrapp et al., 2020). 이러한 형태적 유사성 때문에 2019-nCoV 역시 ACE2 수용체를 통해 숙주세포의 표면에 강하게 부착한다는 사실이 밝혀졌고, 스파이크단백질과 ACE2의 결합체의 분자구조도 최근 밝혀졌다(Zhou et al., 2020, Yan et al., 2020).
스파이크단백질을 통한 2019-nCoV와 숙주세포의 결합이 바이러스가 세포에 침투했다는 것을 의미하지는 않는다. 결합 이후 숙주세포에 존재하는 단백질가위가 스파이크단백질의 일부분을 자른 뒤에야 비로소 바이러스가 세포 내로 침투한다. 2019-nCoV의 경우 호흡기세포막에 있는 ‘TMPRSS2’를 단백질가위로 사용한다는 것이 밝혀졌다(Hoffmann et al., 2020).
향후 자세한 후속연구가 필요하겠지만, 2019-nCoV가 사스바이러스보다 더 빠르게 전염·확산되는 이유도 나왔다. 사스바이러스와 다르게 2019-nCoV가 숙주세포의 ACE2에 더 강하게 결합하고, 스파이크단백질의 일부분이 단백질가위에 의해 더 쉽게 잘라질 수 있도록 변형이 되어 있는 것이 그 원인으로 제시되고 있다.
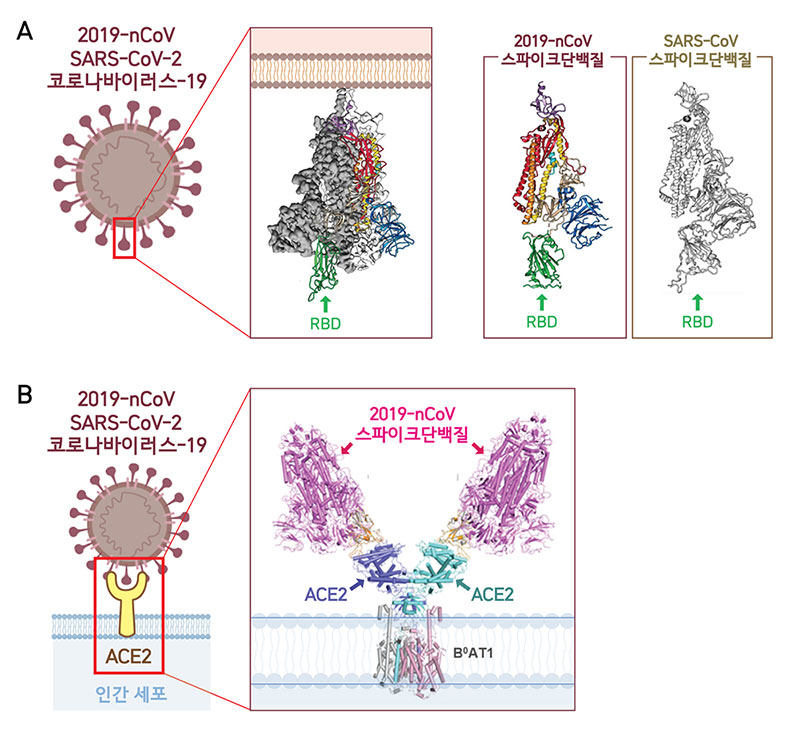
▲ 극저온전자현미경(Cryo-EM)을 통해 2019-nCoV의 3차원 분자구조를 분석한 결과 스파이크단백질 3개가 모여 하나의 덩어리를 이룬 모습이 드러났다. 2019-nCoV와 사스바이러스의 스파이크단백질 구조가 매우 유사함을 확인할 수 있다(A). RBD(Receptor-Binding Domain)는 ACE2 수용체와 결합하는 부분으로, 2019-nCoV가 가진 3개의 RBD 중 하나의 RBD만 세포 표면의 ACE2와 처음 결합하는데 활용된다(B). 바이러스는 RBD를 위‧아래로 자유롭게 움직이며 세포와의 결합력을 높인다.(Wrapp et al., 2020, Yan et al., 2020)
‘가짜 스파이크단백질’과 ‘가짜 수용체’로 예방과 치료
앞서 설명한 것처럼 코로나바이러스와 숙주세포의 결합은 바이러스 감염의 첫 번째 길목이다. 연구자들은 이 길목을 차단하는 전략을 백신이나 초기 치료제 개발에 활용한다. 미국 제약회사 모더나(Morderna)가 지난 24일 개발했다고 발표한 2019-nCoV 백신 후보물질 mRNA(전령RNA)-1273이 그 사례다.
mRNA-1273 백신은 스파이크단백질의 유전정보를 담은 mRNA를 주사함으로써, 2019-nCoV의 스파이크단백질과 똑같이 생긴 ‘가짜 스파이크단백질’이 우리 몸에서 스스로 생성되도록 한다. 만들어진 가짜 스파이크단백질을 이용하여 우리 몸속 면역세포들이 바이러스와 싸울 수 있는 항체를 스스로 만들어내는 원리다. 외부에서 가짜 스파이크단백질을 직접 제조해 몸으로 투여할 수도 있지만, 이 경우에는 백신 개발에 더 오랜 기간이 필요하다. 반면, 모더나는 25일 만에 구조설계 및 시험생산까지 완료했고, 올해 4월 임상 1상에 돌입한다고 미국 국립보건원(NIH) 산하 국립알레르기감염병연구소(NIAID)는 밝혔다.
mRNA-1273이 가짜 스파이크단백질을 만든다면, ‘가짜 수용체’를 만드는 전략도 있다. 중국에서 개발했다고 밝힌 COVID-19의 초기 치료제 후보물질은 ‘재조합 ACE2’다. 재조합 ACE2는 외부에서 ACE2 수용체를 제작한 뒤 몸속으로 주입하는 원리로 2019-nCoV를 중화한다는 의미에서 중화 단백질의약품으로도 불린다. 이 치료 후보물질은 유입된 바이러스가 재조합 ACE2를 진짜 수용체로 인식하여 결합하도록 만든다. 가짜 수용체와 결합한 바이러스는 자연스레 사멸한다.
사스바이러스와 2019-nCoV의 스파이크단백질 구조가 유사하다는 점에 착안해 기존에 개발되고 있던 사스바이러스 중화 단백질의약품 중 일부를 코로나바이러스-19 치료제로 활용하고자 하는 시도들도 이뤄지고 있다. 국내 연구진(한국화학연구원 CEVI융합연구단)도 최근 이 전략을 제시했다. 연구진은 컴퓨터를 이용한 분자구조 시뮬레이션을 통해 기존 사스 중화항체 2개와 메르스 중화항체 1개가 2019-nCoV와 결합할 수 있을 것으로 예측한 결과를 지난달 27일 학술논문 사전공개 사이트(bioRxiv)에 발표했다(Park et al, 2020).
위에 소개한 백신 및 치료제 개발 사례는 2019-nCoV가 세포 속으로 침투하는 첫 번째 길목을 차단하는 효과적인 전략이다. 하지만 이미 바이러스가 세포 내부로 들어와서 폭발적인 증식이 일어난 경우는 이 전략만으로 역부족이다. 바이러스의 세포 내 증식 원리에 기반을 둔 또 다른 치료전략에 대해서는 다음 리포트에서 다뤄보도록 하겠다.
글 | 김호민 기초과학연구원(IBS) 바이오분자 및 세포구조 연구단 CI‧KAIST 의과학대학원 부교수(단백질 구조생화학)
편집 | IBS 커뮤니케이션팀
발행일 | 2020년 3월 5일
참고문헌
- Cui, J., Li, F., and Shi, Z.L. (2019). Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol 17, 181-192.
- Lu, R., Zhao, X., Li, J., Niu, P., Yang, B., Wu, H., Wang, W., Song, H., Huang, B., Zhu, N., et al. (2020). Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 395, 565-574.
- Park, T., Lee, S.-Y., Kim, S., Kim, M.J., Kim, H.G., Jun, S., Kim, S.I., Kim, B.T., Park, E.C., and Park, D. (2020). Spike protein binding prediction with neutralizing antibodies of SARS-CoV-2. bioRxiv, 2020.2002.2022.951178.
- Hoffmann, M., Kleine-Weber, H., Schroeder, S., Kruger, N., Herrler, T., Erichsen, S., Schiergens, T. S., Herrler, G., Wu, N-H., Nitsche, A., Muller M. A., Drosten, C., Pohlmann, S (2020). SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor. Cell, DOI: 10.1016/j.cell.2020.02.052.
- Walls, A. C., Park, Y-J, Tortorici, M. A., Wall, A., McGuire, A. T., Veesler, D. (2020) Structure, Function and antigenicity of the SARS-CoV-2 spike glycoprotein, Cell, DOI: 10.1016/j.cell.2020.02.058.
- Wrapp, D., Wang, N., Corbett, K.S., Goldsmith, J.A., Hsieh, C.L., Abiona, O., Graham, B.S., and McLellan, J.S. (2020). Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science.
- Wu, F., Zhao, S., Yu, B., Chen, Y.M., Wang, W., Song, Z.G., Hu, Y., Tao, Z.W., Tian, J.H., Pei, Y.Y., et al. (2020). A new coronavirus associated with human respiratory disease in China. Nature.
- Yan, R., Zhang, Y., Li, Y., Xia, L., Guo, Y., and Zhou, Q. (2020). Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2. Science, DOI: 10.1126/science.abb2762
- Zhou, P., Yang, X.L., Wang, X.G., Hu, B., Zhang, L., Zhang, W., Si, H.R., Zhu, Y., Li, B., Huang, C.L., et al. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature.
- Zhu, N., Zhang, D., Wang, W., Li, X., Yang, B., Song, J., Zhao, X., Huang, B., Shi, W., Lu, R., et al. (2020). A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med 382, 727-733.
본 글의 저작권은 기초과학연구원에 있습니다. 공유 및 재사용 시에는 출처를 명시해주시기 바랍니다.
|

 뉴스센터
뉴스센터

 뉴스센터
뉴스센터